
Как образуются кристаллы
Чтобы ответить на этот вопрос, необходимо вспомнить современную теорию строения вещества и как это вещество будет заполнять пространство при переходе в твердое состояние.
Химическим процессам, протекающим между элементами, обязаны мы многообразием окружающего нас мира. Возможное количество комбинаций между элементами бесконечно велико и в природе использовано далеко не полностью. Своей" деятельностью человек еще долго будет исправлять "ошибки природы", как в качественном, так и в количественном отношении, и синтетическим путем будет получать необходимые ему материалы, в том числе и драгоценные камни.
Мельчайшую частичку простого вещества мы называем атомом, а мельчайшую частичку сложного вещества - молекулой*. Молекула всегда состоит из нескольких атомов одного и того же элемента или различных элементов. Количество атомов в молекуле для некоторых веществ может быть неограниченно большим, как, например, у естественных или искусственных полимеров (каучук, полиэтилен, алмаз и т. д.). Химические и физические свойства молекулы и атома неделимы; они соответственно являются носителями химических и физических свойств данного вещества или элемента.
* (В твердых телах с ионной связью понятие "молекула" теряет свой обычный смысл, так как катионы и анионы до некоторой степени обобществлены. Поэтому в кристаллохимии взамен понятия молекула чаще пользуются понятием "структурная единица", т. е. минимальное количество катионов и анионов, кристаллохимически связанных между собой, которое представляет простейший элемент повторяемости при сплошном заполнении пространства данным веществом.)
Когда-то элементарной частицей, т. е. далее неделимой, считали молекулу, затем - атом.
Понятие "элементарная частица" определяется, следовательно, уровнем наших знаний и отделяет то, что известно, от того, что мы еще не знаем. Дальнейшее развитие науки показало, что и атомы не элементарны.
Выяснилось, что атомы имеют сложную систему, состоящую из ядра и движущихся вокруг него электронов. Электроны являются атомами электричества, а ядра атомов состоят из протонов и нейтронов*. Положительный заряд ядра уравновешивается в атоме отрицательным зарядом электронов, которые находятся в непрерывном движении на некотором удалении от ядра, так что атом в целом остается электрически нейтральным. Недостаток или избыток в атоме электронов приводит к образованию ионов, т. е. к положительно и отрицательно заряженным атомам. Атомы, в которых не хватает электронов, называются катионами, а атомы, в которых имеется избыток электронов, называются анионами.
* (Протон - ядро атома водорода (простейшее из ядер). Протон имеет положительный заряд. Нейтрон по массе равен протону, но не имеет электрического заряда.)
В электрически нейтральном атоме количество протонов и, соответственно, количество электронов равно порядковому номеру данного элемента в периодической системе Д. И. Менделеева.
В каждом грамматоме* любого элемента находится 6,02•1023 атомов. Атомы очень малы. Радиусы атомов, или, вернее, радиусы их эффективного действия, от водорода до урана колеблются в пределах от 0,46 Å до 1,53 Å (ангстрема)**. Величина радиусов ионов, из которых главным образом и состоят неорганические соединения, имеет еще большие колебания.
* (Грамматом - это атомный вес элемента, выраженный в граммах.)
** (Знак Å обозначает меру длины - ангстрем. Один ангстрем равен 10-8 см.)
Так, положительно заряженные ионы - катионы имеют размер радиусов в пределах от 0,11 Å для пятизарядного азота до 1,65 Å для катиона цезия; размеры радиусов анионов лежат в пределах от 1,32 Å (у кислорода) до 2,6 Å (у углерода и олова). Для мира атомов подобные колебания размеров их радиусов весьма значительны. Образование анионов и катионов, т. е. возникновение отрицательно или положительно заряженных атомов (ионов), объясняется тем, что атомы различных элементов имеют различное "сродство" к электронам, обусловленное главным образом порядком размещения электронов вокруг атомного ядра и образованием устойчивых электронных конфигураций.
В зависимости от места положения элемента в периодической системе электроны в атоме могут располагаться на семи энергетических уровнях, соответственно с семью периодами таблицы Д. И. Менделеева. На каждом энергетическом уровне может находиться строго определенный максимум электронов, отвечающий инертному газу, стоящему в конце данного периода.
Химическое взаимодействие между атомами проявляется главным образом за счет внешних, валентных электронов. Элементы, содержащие одинаковое количество электронов на внешней сфере, являются аналогами. По этому принципу элементы разбиты по группам и подгруппам.
В процессе химического взаимодействия ядра атомов любого элемента стремятся окружить себя наиболее устойчивой электронной конфигурацией, подобно ближайшему инертному газу. С этой "целью" между атомами различных элементов идет постоянная "борьба" за обладание электронами. При этом металлические элементы теряют свои валентные электроны, тогда как неметаллические элементы их приобретают.
В "борьбе" за обладание электронами, в "игре" электрических сил заключена суть химических превращений. При взаимодействии натрия и хлора атомы натрия отдают свой единственный валентный электрон атомам хлора; при этом внешняя электронная оболочка хлора становится подобной аргону. В этом случае атом хлора полностью "перетянул" электрон у атома натрия и превратился в анион, а атом натрия, потеряв свой электрон, стал положительно заряженным катионом.
Дальнейшее взаимодействие между двумя противоположно заряженными атомами подчиняется закону Кулона. Подобный тип химической связи называется электростатической, или ионной, связью. Другой крайний случай химической связи наблюдается тогда, когда валентные электроны поступают в общее пользование между взаимодействующими атомами.
В конечном итоге достигается та же самая "цель", "партнеры" взаимно дополняют свои внешние электронные оболочки до уровня ближайшего инертного газа, т. е. до более устойчивой конфигурации, но при этом остаются совершенно нейтральными. Такой тип связи называется неполярной. В этом случае валентная связь осуществляется парой электронов, в равной мере принадлежащей обоим взаимодействующим атомам. Подобная связь проявляется в молекуле водорода и в тех случаях, когда взаимодействуют тождественные или близкие в химическом отношении атомы.
Возможно, что подобного рода связь имеется между атомами углерода в алмазе. Между крайними типами валентной связи - ионной и неполярной - имеется промежуточный, третий, основной тип валентной связи - полярная связь. Полярная связь проявляется в том случае, когда реагирующие атомы неравноценны и образовавшаяся электронная пара несколько оттянута к одному из атомов, но не настолько, чтобы можно было образовать самостоятельные ионы. По этой причине неполярную и полярную связь иногда объединяют под одним названием ковалентной; этот тип связи иногда называют также атомной или гомеополярной. Особый тип химической связи проявляется в металлах, где между положительно заряженными ионами свободно перемещаются электроны. Это так называемая металлическая связь.
В неорганическом мире проявляется преимущественно ионный тип связи. Представьте себе ионы в виде упругих, несжимаемых шаров, такое допущение вполне возможно для стационарных условий*, и постарайтесь разместить их в пространстве наиболее плотно для случая однородных и разнородных ионов.
* (Атомы и ионы несколько изменяют свои размеры в зависимости от температуры и давления, которые они испытывают. Поэтому и возможны перегруппировки ионов при воздействии на их соединения высоких температур и давлений и образование новых продуктов реакции.)
У простых веществ - элементов все атомы или ионы будут одинаковы по величине, например, у алмаза и графита радиус атома углерода равен 0,77 Å. У сложных веществ, как например у корунда, имеется два сорта атомов - алюминий и кислород, размер их ионов в соединении различен: катион алюминия имеет радиус 0,57 Å, а анион кислорода - 1,32 Å.
При укладке однородных атомов наиболее плотная упаковка шаров получается в том случае, когда в каждом слое один шар окружает шесть других шаров. Подобную упаковку очень наглядно можно осуществить, укладывая шарикоподшипники или дробинки послойно в стеклянный цилиндр. После заполнения первого слоя мы увидим, что шары, не соприкасающиеся со стенками цилиндра, окружены шестью другими такими же шарами и что не все пространство заполнено шарами, между ними остались пустоты, лунки.
После заполнения второго слоя шары займут половину лунок первого слоя.
При заполнении третьего слоя шары можно разместить двумя способами: поместить их в лунки, находящиеся над центрами шаров первого слоя, или в сквозные лунки, находящиеся над лунками первого слоя. В первом варианте третий слой шаров будет точно повторять расположение первого слоя, а во втором варианте такого повторения не будет.
Следовательно, в зависимости от способа заполнения третьего слоя возможны два варианта плотнейшей упаковки атомов.
В первом случае будет самая простая двуслойная упаковка, так как третий слой лежит над первым и точно его повторяет, четвертый будет лежать над вторым и т. д. Упаковка атомов, где элемент повторяемости состоит из трех слоев, называется гексагональной: в первом слое - семь атомов (один из них, центральный, окружен шестью шарами), во втором - три атома, располагающиеся в трех из шести лунок первого слоя, а третий слой повторяет первый.
По такому типу упаковки построены кристаллы магния, графита, титана, циркония, гафния и целого ряда других элементов.
Во втором случае будет трехслойная упаковка, так как четвертый слой можно положить таким образом, что он повторит первый, а пятый повторит второй и т. д.
Трехслойные упаковки кристаллов наиболее распространены. Из трехслойной упаковки можно выделить кубическую элементарную ячейку, повторением которой заполняется все пространство. Эту ячейку можно представить себе в виде куба, в вершинах которого и в середине граней находятся центры атомов.
По такому типу кристаллизуются алмаз, кремний, германий и некоторые другие элементы.
Теоретически возможное число упаковок при увеличении числа слоев может возрастать до бесконечности, однако практическое значение имеют главным образом два разобранных выше типа плотнейшей упаковки шаров: гексагональная плотнейшая упаковка и кубическая.
Эти типы упаковок шаров одинакового размера, как уже ранее отмечалось, не полностью заполняют пространство, около одной четвертой части его остается незанятой. Между шарами остаются пустоты двух типов: одни пустоты окружены четырьмя шарами, центры тяжести которых размещены по вершинам правильного тетраэдра, - это так называемые тетраэдрические пустоты; другие пустоты окружены шестью шарами, центры тяжести которых находятся в вершинах правильного октаэдра, - это так называемые октаэдрические пустоты. Октаэдрических пустот в плотнейшей упаковке столько же, сколько и шаров в этой упаковке, а тетраэдрических - в 2 раза больше.
При заполнении пространства шарами разного размера маленькие шары, естественно, будут стремиться попасть в пустоты между большими шарами. По такому принципу строится в большинстве случаев упаковка твердых тел, образованых различными элементами.
Рентгеновские исследования структуры кристаллов подтвердили представления о том, что кристаллы строятся па принципу плотнейшей упаковки шаров. На примере плотнейшей упаковки шаров мы видим, что частицы, образующие кристаллы (атомы или ионы), располагаются в строго закономерном порядке: если центры тяжести этих частиц вообразить в виде точек, то эти точки расположатся как бы в узлах пространственной решетки.
На рис. 5 представлена модель такой кристаллической решетки.
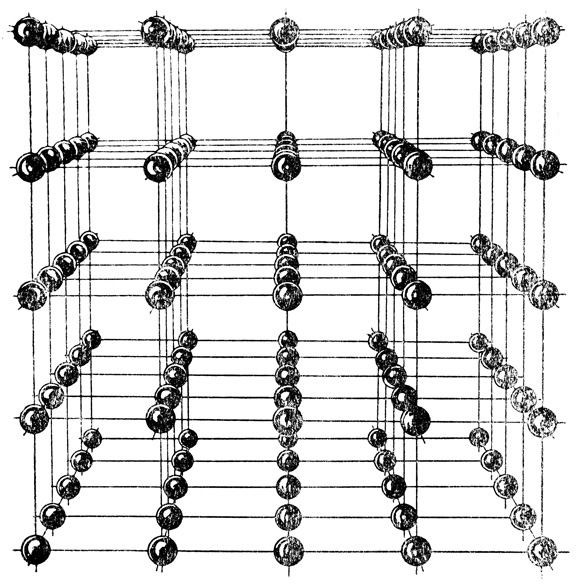
Рис. 5. Модель кристаллической решетки
На рис. 6 изображена модель шаровой упаковки ионов в кристаллах поваренной соли, где между крупными ионами хлора в октаэдрических пустотах, размещаются катионы натрия.
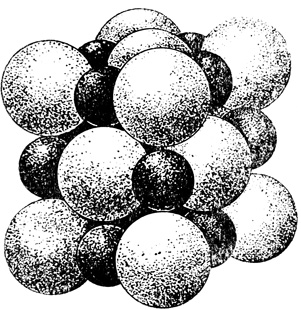
Рис. 6. Упаковка ионов в кристаллах поваренной соли
Как следствие упорядоченного расположения в пространстве слагающих кристаллы частиц свойства этих кристаллов в различных направлениях будут различны - анизотропны*.
* (В аморфных телах физические свойства одинаковы во всех направлениях. В качестве примера аморфного тела можно назвать обычное стекло или обсидиан (минерал вулканического происхождения).)
Действительно, если на рис. 5, например, с нижней левой точки провести прямые, веером расходящиеся вправо по плоскости чертежа, то легко заметить, что плотность расположения узлов пространственной решетки на этих прямых будет различна, а некоторые прямые пройдут мимо узлов пространственной решетки, т. е. в конечном итоге плотность ионов, или атомов, в реальном кристалле в различных направлениях будет различна, а следовательно, в различных направлениях будут различны и физико-химические свойства этих кристаллов.
Яркий пример анизотропности представляют такие известные минералы, как слюда, дистен, кордиерит и всем хорошо известная поваренная соль.
Слюда очень легко расщепляется на тонкие пластинки исключительно в одном направлении, параллельном плоскостям спайности.
У дистена наблюдается резкое изменение твердости, в зависимости от направления.
Кордиерит кажется различно окрашенным в зависимости от того, в каком направлении его рассматривать, - окраска может быть желтой, синей и серовато-синей.
Если из монокристалла поваренной соли в различных направлениях вырезать стержни и испытать их на разрыв, то оказывается, что прочность стержня на разрыв, вырезанного вдоль диагонали куба, будет почти в четыре раза больше по сравнению с прочностью стержня, вырезанного параллельно плоскостям куба.
Кристаллы имеют и целый ряд других замечательных свойств, так, например, исландский шпат обладает свойством двойного лучепреломления. Если смотреть на предметы через кристалл исландского шпата, то все предметы будут раздваиваться.
Кристаллы горного хрусталя или синтетического кварца и некоторые другие обладают пьезоэлектрическими свойствами*.
* (Явление пьезоэлектричества состоит в том, что в кристаллах, лишенных центра симметрии, наблюдается электрическая поляризация под действием механических напряжений.)
Естественным следствием закономерного расположения ионов в кристалле является их симметрия. Все кристаллы симметричны, и это одно из наиболее важных их свойств. Кристаллы "блещут своей симметрией".
По мнению выдающегося кристаллографа нашего времени академика А. В. Шубникова, симметрия кристаллов "проявляется в их форме, структуре и почти во всех свойствах; ни в одной науке симметрия не играет той роли, какую она играет в кристаллографии. Всестороннее использование идеи симметрии для предсказания, описания и истолкования свойств кристаллов и явлений, в них происходящих, как раз и служит тем специфическим методом, которым кристаллография отличается от всех других наук. В этой связи особенно должна быть отмечена выработанная кристаллографией классификация кристаллов по признаку их симметрии: разделение кристаллов на 32 класса макросимметрии, основанное на работе А. В. Гадолина, и разделение их на 230 групп микросимметрии, основанное на работах Е. С. Федорова и А. Шёнфлиса"*.
* (А. В. Шубников. Кристаллы в науке и технике. Изд-во АН СССР, М., 1956, стр. 4.)
Форма огранки кристаллов есть следствие правильного, закономерного расположения ионов в кристалле. В естественной форме огранки наиболее ярко проявляется симметрия кристаллов. Ребра и плоские грани кристаллов возникают по тем направлениям или соответственно по тем плоскостям, где наблюдается наибольшая плотность частиц, слагающих данный кристалл, если учесть при этом, что в каждом минерале, а следовательно и в драгоценном камне, слагающие его частицы расположены в пространстве с присущей только данному виду камней комбинацией, то вполне естественно, почему отдельные минералы всегда стремятся повторять определенные характерные для них формы. Число форм природных кристаллов не безгранично, внешнее огранение кристаллических многогранников описывается с помощью 47 простых форм*. Тема данной книги не позволяет остановиться более подробно на закономерностях, проявляющихся при образовании кристаллов, желающие могут обратиться к специальной литературе по кристаллографии**.
* (Простой формой называется совокупность граней кристалла, связанных между собой элементами симметрии.)
** (Например, кн. Г. М. Попова и И. И. Шафрановского "Кристаллография". Госгеолтехиздат, М., 1955.)
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'