
VIII класс. Силикаты
Общие замечания. К классу силикатов относится огромное количество минералов. На долю их приходится примерно одна треть всего числа известных в природе минеральных видов. Количественное значение их окажется еще более разительным, если мы примем во внимание степень распространенности и весовые количества их в земной коре.
По подсчетам А. Е. Ферсмана, силикаты составляют 75% земной коры. Если мы сюда прибавим еще 12% свободного кремнезема (главным образом в виде кварца и опала), то нам станет совершенно ясной та исключительная роль, которую играет кремний в геохимии вообще.
Многие силикаты являются важнейшими породообразующими минералами не только во всех магматических горных породах, их гидротермально измененных разностях и контактово-метасоматических образованиях, но также в продуктах их выветривания, во многих осадочных горных породах (главным образом глинах и глинистых сланцах), а также в разнообразных кристаллических сланцах. Значительную роль они играют и в минеральных составах почти всех месторождений полезных ископаемых, и не только как спутники рудных минералов, но в ряде случаев как носители ценных металлов (Ni, Zn, Be, Zr, Li, Cs, Rb, U, TR и т. д.). Не мало мы знаем и неметаллических полезных ископаемых, представленных силикатами. К числу их принадлежат, например, асбест, каолин, так называемые отбеливающие глины, полевые шпаты как сырье для огнеупоров, керамики и т. д., не говоря уже о различных строительных материалах. Ряд силикатов (изумруд, аквамарин, турмалин, топаз, родонит, нефрит и др.) издавна используется в качестве драгоценных и поделочных камней.
Главнейшие элементы, входящие в состав силикатов, следующие:
Na, К, Li Ca, Mg, Fe••, Mn••, Be Si, Zr, Ti Al, Fe•••, В О, F, H (в виде H1+, [ОН]1- и H2O).
Многочисленные другие элементы (Rb, Cs, Ba, Sr, Pb, Zn, Ni, Со, Cu, Bi, Sb, Cr, V, Sc, Y, TR, Th, Sn, U, Nb, S, Cl, С в виде [CO3]2-, P и другие) присутствуют в относительно редких минеральных видах.
Несмотря на сравнительно небольшое количество приведенных выше главнейших элементов, участвующих в составе силикатов, в природе мы наблюдаем необычайное разнообразие соединений, часто весьма сложной конституции и переменного состава. В ранее рассмотренных классах кислородных солей химические состава минералов выражались, как мы видели, довольно простыми химическими формулами. Среди силикатов к числу таких соединений принадлежит сравнительно небольшое количество минералов. В очень многих случаях данные химических анализов нередко не позволяют вывести простых формул вследствие наличия многочисленных примесей и некоторого непостоянства состава минеральных видов. Это явление не может быть объяснено неточностью самих химических анализов или микроскопическими включениями каких-либо посторонних минералов. Сложность состава обусловлена, как мы увидим при описании отдельных групп минералов, кристаллохимическими особенностями этих соединений.
О конституции силикатов. Еще до рентгенометрических исследований вопросу о химической природе силикатов было уделено весьма большое внимание. Им занимались такие крупные ученые, как Вернадский, Чермак, Грот, Кларк и много других.
К разрешению этой труднейшей проблемы подходили путем тщательного сопоставления эмпирических формул минералов с учетом известных в то время из химии валентностей отдельных элементов, путем детального изучения химических и физических свойств минералов и продуктов лабораторного синтеза, поведения минералов в природных условиях, особенно продуктов их разложения, что приводило к выявлению ряда эмпирических закономерностей. В общей сложности была проделана огромная работа.
На основании многих косвенных умозаключений были созданы различные, нередко противоречивые, гипотетические представления по вопросу о конституции многих сложных по составу силикатов с построением тех или иных схем структурных формул. Ряд положений, выведенных с изумительной по глубине интуицией (Вернадский), полностью сохранил свое значение и до сих пор, но некоторые положения при применении современных точных методов исследования не получили подтверждения.
Несмотря на то что прежние гипотетические представления в настоящее время в большинстве утратили свое значение, следует все же сказать, что они сыграли бесспорную историческую роль в развитии минералогии силикатов. Без этих исследований, в особенности по выявлению свойств минералов, расшифровка ряда сложнейших кристаллических структур, в частности полевых шпатов, была бы в значительной мере затруднена.
Коснемся некоторых вопросов терминологии, укоренившейся в минералогической литературе.
Силикаты на основе представлений о молекулярном строении вещества рассматривались как соли (кислые, средние и основные) многочисленных гипотетических кислот: кремневых, алюмокремневых, титано-цирконо-кремневых и др. С этой точки зрения среди собственно силикатов выделялись:
- ортосиликаты, как соли кислоты H4SiO4,
- метасиликаты, как соли кислоты H2SiO3,
- пиросиликаты, как соли кислоты H6Si2O7, и т. д.
Если еще для первого типа соединений, как увидим ниже, по многим свойствам, в том числе и строению кристаллических решеток, мы действительно можем усмотреть признаки типичных солей, аналогичных ранее описанным фосфатам, сульфатам и др., то в последующих типах солей, особенно в более богатых кремнеземом, эти признаки заметно ослабляются. Последние типы соединений фактически занимают промежуточное положение между типичными солями и окислами (в частности SiO2).
Упомянем также о том, что в литературе можно встретить другие, менее удачные названия типов силикатов, основанные на количественных соотношениях между атомами кислорода у ангидрида (SiO2) и оснований (по эмпирическим формулам). Ортосиликаты (например, форстерит - 2MgO•SiO2) назывались моносиликатами, так как отношение количеств атомов кислорода у SiO2 и MgO (2 : 2) равно 1, метасиликаты - дисиликатами (например энстатит - MgO•SiO2); альбит (Na2O•Al2O3•6SiO2) с этой точки зрения назывался трисиликатом.
Современные представления о конституции силикатов развились главным образом на основе обобщений в области кристаллохимии (Брэгг, Е. Шибольд, Л. Паулинг, Н. В. Белов).
Рентгенометрические исследования многих десятков, и притом самых различных по составу, силикатов привели к следующим весьма важным выводам, относящимся к особенностям кристаллических структур этих соединений.
![Рис. 271. Типы отдельных групп кремнекислородных тетраэдров (в двух изображениях). а - единичпый изолированный тетраэдр [SiO><sub>4</sub>]<sup>4-</sup>; б - группа из двух связанных общей вершиной Тетраэдров [ Si<sub>2</sub>O<sub>7</sub>]<sup>6-</sup>; в - группа из трех тетраэдров, связанных в кольцо [Si<sub>3</sub>O<sub>9</sub>]<sup>6-</sup>; г - группа из четырех тетраэдров, связанных в кольцо [Si<sub>4</sub>O<sub>12</sub>]<sup>8-</sup>; д - группа из шести тетраэдров, связанных в кольцо [Si<sub>6</sub>O<sub>18</sub>]<sup>12-</sup>](pic/000283.jpg)
Рис. 271. Типы отдельных групп кремнекислородных тетраэдров (в двух изображениях). а - единичпый изолированный тетраэдр [SiO4]4-; б - группа из двух связанных общей вершиной Тетраэдров [ Si2O7]6-; в - группа из трех тетраэдров, связанных в кольцо [Si3O9]6-; г - группа из четырех тетраэдров, связанных в кольцо [Si4O12]8-; д - группа из шести тетраэдров, связанных в кольцо [Si6O18]12-
Во всех изученных силикатах каждый ион Si4+ всегда находится в окружении четырех ионов О2-, располагающихся в углах по тетраэдру вокруг него (рис. 271). Связь ионов кислорода с кремнием гораздо сильнее, нежели с другими металлами, играющими роль катионов в кристаллических структурах силикатов. Размеры этих кремнекислородных тетраэдров почти строго постоянны. Расстояние Si-О составляет всего 1,6Å. Это обстоятельство, а также другие рентгенометрические данные убеждают в том, что связь Si-О является не совсем полярной.
Таким образом, кремнекислородный тетраэдр, т. е. группа [SiO4]4-, является основной структурной единицей всех силикатов.
Кремнекислородные тетраэдры в кристаллических решетках силикатов могут находиться либо в виде изолированных друг от друга структурных единиц SiO4, либо могут сочленяться друг с другом разными способами, образуя сложные комплексные анионные радикалы. При этом сочленение совершается только через углы тетраэдров с образованием общих вершин, но не через ребра или грани. Наиболее полный случай таких сочленений мы будем, очевидно, иметь тогда, когда все четыре вершины каждого тетраэдра одновременно являются общими и для окружающих четырех тетраэдров SiO4. Такой случай, как мы знаем, имеет место для кристаллических структур минералов группы кварца (см. стр. 244) с общей формулой SiO2.
Следовательно, отношение О : Si в комплексных анионных радикалах силикатов может колебаться в пределах от 4 : 1 до 2 : 1.
В зависимости от того, происходит ли сочленение кремнекислородных тетраэдров и каким образом оно происходит, мы будем иметь различные пространственные формы анионных комплексных радикалов.
Приведем наиболее типические примеры их:
а) Комплексный анион представлен изолированными тетраэдрами [SiO4]4- (рис. 271-а), удерживаемыми в решетке с помощью катионов других металлов. Общий отрицательный заряд каждой такой группы равен четырем (каждый ион кислорода отдает кремнию лишь половину своего отрицательного заряда, равного двум). Этот тип структуры широко представлен в ортосиликатах, например, цирконе Zr[SiO4], форстерите Mg2[SiO4], гранате Ca3Al2[SiO4]3 и т. д.
б) Комплексный анионный радикал представлен изолированными группами [Si2O7]6-, состоящими из двух связанных друг с другом кремнекислородных тетраэдров SiO4 с одной общей вершиной (рис. 271-б). Легко подсчитать, что общий отрицательный заряд этого комплекса равен шести. Кислородный ион, располагающийся в общей вершине, электростатически инертен. Следовательно, активные кислородные ионы, остаточные отрицательные заряды которых в кристаллической структуре нейтрализуются катионами металлов, располагаются на двух противоположных друг другу концах анионного комплекса (рис. 271-б). Примеры соединений (пиросиликатов), обладающих такими комплексными анионами, не многочисленны (тортвейтит-Sc2 [Si2O7].
в) Комплексный анион состоит из трех, четырех, шести кремнекислородных тетраэдров, связанных друг с другом уже через две общие вершины в замкнутые плоские изолированные кольца (рис. 271-в, г и д). Комплексные анионы в этих случаях представлены соответственно: [Si3O9]6-, [Si4O12]8- и [Si6O18]12-. Общая валентность каждого такого радикала определяется числом наружных кислородных ионов, каждый из которых обладает одной некомпенсированной отрицательной валентностью. Примерами могут служить: бенитоит-BaTi[Si3O9] и берилл-Be3Al2[Si6O18]. По прежней классификации соединения данного структурного типа на основании одной лишь химической формулы относили к метасиликатам-R••[SiO3]. Следует добавить, что Н. В. Беловым в некоторых силикатах (миларит, турмалин) доказан новый тип анионов в виде комплексов, представленных сдвоенными (двухэтажными) кольцами.
г) Комплексные анионы представлены одномерными непрерывными цепочками связанных друг с другом кремнекислородных тетраэдров. В верхней части рис. 272 изображена простая одинарная цепочка, в которой каждый тетраэдр связан с соседними тетраэдрами двумя углами с инертными ионами кислорода в них, а два активных кислородных иона в каждом тетраэдре расположены таким образом, что один из них находится над ионом Si (в плоскости рисунка), а другой откинут попеременно то в верхнюю, то в нижнюю стороны. Между такими линейно-вытянутыми радикалами располагаются катионы металлов.
Как и в предыдущем типе, в каждом кремнекислородном тетраэдре два иона кислорода целиком принадлежат иону Si, а два остальных (инертные) как бы делятся пополам между соседними тетраэдрами. В сумме на каждый ион Si приходится три иона кислорода, из которых два имеют по одной свободной валентности. Таким образом, состав и валентность таких радикалов могут быть выражены в следующем виде: n [SiO3]2-, где n = ∞ и означает полимеризацию. Такое строение кислотного радикала характерно для группы пироксенов, относимых к типичным метасиликатам с общей формулой R••[SiO3]. Однако здесь так же, как и в предыдущем типе кристаллических структур, мы не наблюдаем изолированных групп SiO3*.
*(Однако, как для данного комплексного аниона, так и для всех последующих типов сочленения тетраэдров в беспрерывные комплексы, в квадратных скобках будем обозначать условную единицу, в данном случае единицу длины цепочки одного периода в 5,25 Å (см. рис. 272). Таким образом, формула аниона для пироксенов будет [Si2O6])
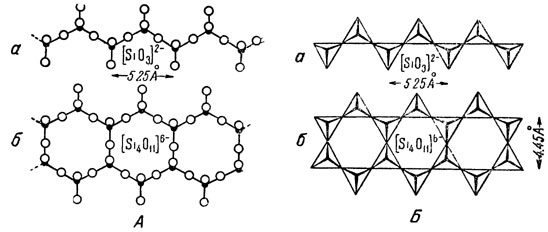
Рис. 272. Типы одномерных непрерывных цепочек кремнекислородных тетраэдров (в двух изображениях - А и Б) а - одинарная цепочка; б - двойная цепочка (лепта). Вершины тетраэдров, направленные к наблюдателю, утолщены (б)
В нижней части рис. 272-б приведена двойная цепочка или, вернее, лента непрерывно связанных кремнекислородных тетраэдров. Она может быть получена из одинарной цепочки путем ее отражения в плоскости, перпендикулярной к чертежу и параллельной оси цепочки. Такие ленточные сочленения кремнекислородных тетраэдров характерны для группы амфиболов. Нетрудно подсчитать, что состав и валентность таких радикалов, в пределах одного периода (5,25 Å) выражается в виде формулы [Si4O11]6-.
Необходимо упомянуть о том, что в кремнекислородных тетраэдрах ион Si иногда частично заменяется ионом Al, находящимся также в окружении четырех ионов кислорода.
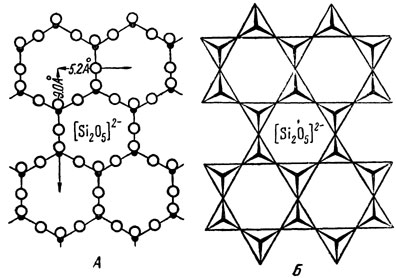
Рис. 273. Лист кремнекислородных тетраэдров гексагонального строения
д) Комплексные анионы представлены двумерными слоями кремнекислородных тетраэдров. Строение таких слоистых радикалов характеризуется тем, что тетраэдры соединяются друг с другом уже тремя общими вершинами и образуют плоский слой непрерывной протяженности в двух измерениях (рис. 273) на-подобие гексагональной сетки. Активные ионы кислорода (по одному от каждого тетраэдра) направлены все в одну сторону (вверх или вниз от плоскости чертежа), образуя особый, активный лист в слое тетраэдров. Химическая формула такого анионного слоя в пределах гексагона выразится следующим образом: [Si2O5]2-. При этом нередко часть ионов Si в кремнекислородных тетраэдрах бывает заменена ионами Al с координационным числом 4. Каждый такой слой с помощью листа активных ионов кислорода через катионы металлов тем или иным способом связан с другими, совершенно аналогичными по строению слоями. Примерами таких кристаллических структур могут служить структуры пластинчатых минералов, обладающих весьма совершенной спайностью в одном направлении (слюды, тальк, хлориты и т. д.).
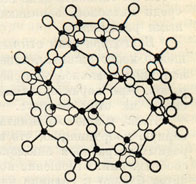
Рис. 274. Алюмо-кремнекис-лородный каркас в кристаллической структуре нозеана
е) Комплексные анионы образованы непрерывными трехмерными каркасами кремнекислородных тетраэдров, у которых каждый ион кислорода принадлежит одновременно двум тетраэдрам. Нет ни одного угла тетраэдра с активным кислородным ионом. Как уже указывалось, примером таких каркасов являются минералы группы кварца, представляющие как бы чистый ангидрид с формулой SiO2. Однако подобные же кристаллические решетки наблюдаются и в силикатах (рис. 274). Правда, при этом часть ионов Si4+ всегда бывает заменена ионами Al3+ с тем же координационным числом (на этом вопросе ниже специально остановимся). Химическая формула комплексных анионов каркасного строения в общем виде может быть выражена так: [(Sin-xAlx)O2n]x-. Вследствие того что какая-то часть ионов Si4+ заменена ионами Al3+ (при сохранении общего числа кислородных ионов), этот радикал, как легко подсчитать, обладает все же некоторым остаточным отрицательным зарядом. Примером могут служить полевые шпаты: Na[Si3AlO8], Ca[Si2Al2O8] и многие другие минералы. Катионы металлов Na, Ca и др., компенсирующие остаточную отрицательную валентность анионных каркасов, располагаются внутри их (в соответствующих "полостях" решетки).
Таким образом, общие черты кристаллохимии силикатов на основе деления комплексных анионов из тетраэдров SiO4 на 0-, 1-, 2- и 3-мерные радикалы могут быть сведены в таблицу 12.
Одной из главных и наиболее замечательных особенностей конституции многих силикатов является роль ионов Al в их кристаллических структурах.
До рентгенометрических исследований одни ученые (например Грот, Кларк) считали, что Al по аналогии с Mg, К, Na и другими металлами в конституции силикатов играет роль основания, тогда как В. И. Вернадский доказывал, что Al в силикатах наряду с Si входит в состав кислотных радикалов, в связи с чем он выделял многочисленные алюмокремневые кислоты, их ангидриды и соли (алюмосиликаты).
| Si:О | Формула и тип аниона |
Заряд аниона |
Заряд на 1 Si |
Примеры |
|---|---|---|---|---|
| 1:4 | [SiO4] тетраэдр |
-4 | -4 | Форстерит - Mg2[SiO4] |
| 2:7 | [Si2O7] Удвоенный тетраэдр |
-6 | -3 | Тортвейтит - Sc2[Si2O7] |
| 1:3 | [Si3O9] кольцо |
-6 | -2 | Бенитоит - BaTi[Si3O9] |
| 1:3 | [Si6O18] кольцо |
-12 | -2 | Берилл - Be3Al2[Si6O18] |
| 1:3 | [SiO3]n цепочка |
-2n | -2 | Диопсид - CaMg[Si2O6] |
| 4:11 | [Si4O11]n лента |
-6n | -1,5 | Тремолит - Ca2Mg5[Si4O11]2[OH]2 |
| 2:5 | [Si2O5]n слой |
-2n | -1 | Тальк - Mg3[Si2O5]2[OH]2 |
| 1:2 | [(AlxSin-x)O2n] каркас |
-x | - | Альбит - Na[Si3AlO8] |
Изучение кристаллических структур силикатов с помощью рентгеновских лучей позволило решить этот вопрос. Оказалось, что алюмосиликаты действительно существуют среди соединений класса силикатов. Однако наряду с этим в значительном числе случаев устанавливаются и силикаты алюминия, часто вместе с другими металлами.
Таким образом, Al3+ в конституции силикатов играет двоякую роль: то как компонент анионных радикалов, находясь, так же как и Si4+, в четверном окружении ионов кислорода; то как отдельный катион, один или вместе с катионами других металлов, нейтрализующими отрицательный заряд анионов, располагаясь в шестерном окружении ионов кислорода или гидроксила подобно Mg2+. Известно даже немало случаев, когда в одном и том же силикате одни ионы Al участвуют в комплексном анионе, другие - среди катионов, занимающих промежутки между отрицательно заряженными радикалами.
Благодаря этим открытиям многое из того, что раньше казалось совершенно непостижимым, теперь на основании точнейших физических данных получило реальное объяснение в полном соответствии со свойствами минералов. При характеристике отдельных групп силикатов мы не раз остановимся на этом вопросе.
Итак, в алюмосиликатах ионы кислорода вокруг Al3+ имеют ту же четверную координацию, что и вокруг Si4+. Возможность замены кремнекислородных тетраэдров алюмокислородными вытекает из чисто геометрических соображений: отношение ионных радиусов О2- и Al3+ равно 0,43, т. е. находится близко к границе между возможной четверной координацией аналогично Si4+ и шестерной-аналогично Mg2+. Однако такая замена Si4+ на Al3+ имеет очень важные последствия, весьма существенно сказывающиеся на конституции алюмосиликатов.
В самом деле, в то время как в кремнекислородном тетраэдре SiO4 мы имеем четыре ненасыщенные валентности, в алюмокислородном тетраэдре AlO4 это число возрастает до пяти (8-3=5). Следовательно, каждый алюмокислородный тетраэдр в комплексном анионном радикале увеличивает его отрицательный заряд на единицу и требует его компенсации каким-либо положительно заряженным катионом в соответствии со стереометрией решетки данного соединения. Это легко показать на примере соединений с каркасным строением кристаллических решеток:
Кварц-Si4O8
Альбит-Na[Si3AlO8]
Нефелин-Na2[Si2Al2O8]
Aнортит-Ca[Si2Al2O8] и др.
Отношение Si : Al не обязательно должно быть целым числом, но уравновешивание отрицательных и положительных зарядов для устойчивой кристаллической решетки является безусловно необходимым. Отсюда должно быть ясным, почему данные химических анализов алюмосиликатов не всегда просто рассчитываются на химическую формулу минерала. Например, общая формула роговой обманки имеет следующий вид:
(Ca,Na)2-3(Mg,Al)5[(Si,Al)4O11]2[0,OH]2,
где в радикале отношение Al : Si может меняться от 1 : 3 до 0.
Важно подчеркнуть, что возникновение группы AlO4 может происходить при определенных условиях. Образование каркасов из тетраэдрических групп AlO4 и SiO4 имеет место лишь при одновременном участии в строении решетки относительно крупных по размерам катионов с низким зарядом (Na1+, К1+, Ca2+, Ba2+ и др.)- Таковы многочисленные представители групп полевых шпатов и цеолитов. Характерно, что при выветривании, когда происходит выщелачивание щелочных и щелочноземельных металлов, группы AlO4 разрушаются: в образующемся за счет полевых шпатов каолините Al3+ участвует уже в шестерной координации. То же самое происходит и с другими типами кристаллических структур, в которых присутствуют в качестве составной части анионов группы AlO4.
В средах, богатых глиноземом, группы AlO4 возникают при высоких температурах. Экспериментально показано, что такие минералы, как каолинит и дистен, в которых весь Al3+ присутствует в шестерной координации, в этих условиях (1400-1500гр) частью превращаются в силлиманит или муллит, т. е. в силикаты, содержащие также группы AlO4 с четверной координацией. Характерно, что на кривых нагревания при этом устанавливаются резко выраженные экзотермические эффекты, отвечающие моменту перестройки решетки.
В связи с этим необходимо в двух словах коснуться также вопроса о так называемом каолиновом ядре. В свое время В. И. Вернадский, на основе наблюдений над природными явлениями разрушения минералов и данных экспериментальных исследований, пришел к выводу о существовании в алюмосиликатах, в частности в полевых шпатах, весьма стойкого по отношению к естественным процессам особого ядра состава Al2Si2O7. Сама идея тесной связи Al с Si в глиноземсодержащих силикатах впоследствии оказала неоценимую услугу при расшифровке с помощью рентгенометрических исследований столь сложных в структурном отношении минералов, какими являются алюмосиликаты. При этом, однако, выяснилось, что далеко не все глиноземсодержащие силикаты являются алюмосиликатами, т. е. такими, в которых Al играет одинаковую роль с Si. Но и в алюмосиликатах с их непрерывной протяженностью в пространстве алюмо-кремнекислородных радикалов, строго говоря, не существует обособленности групп, подобных предполагавшемуся "каолиновому ядру". Сам каолинит, образующийся при выветривании алюмосиликатов, как оказалось, по существу является силикатом алюминия, а не алюмосиликатом или "алюмокремневой кислотой".
В составе многих силикатов принимают участие так называемые дополнительные анионы: О2-, [ОН]1-, F1-, Cl1-, [CO3]2- и другие, нейтрализующие избыточный положительный заряд катионов. В ряде случаев допускают, что [ОН]1- и F1- могут заменять ионы кислорода в самих комплексных анионных радикалах, но такая замена обычна для ионов кислорода, не входящих в состав крехмнекислородных тетраэдров.
Наконец, в состав ряда силикатов входит H2O в большинстве случаев цеолитного характера. Молекулы H2O обычно весьма слабо удерживаются кристаллическими решетками в их пустых промежутках или каналах.
Во всех силикатах количество кислородных ионов превалирует над ионами остальных элементов. Так как ион кислорода обладает значительно большей величиной ионного радиуса по сравнению с катионами, то естественно, что размеры элементарных ячеек, как и в других кислородных соединениях, главным образом зависят от числа кислородных ионов в ячейке и их расположения в пространстве.
Отсюда вытекает, что в спликатах, являющихся членами одного и того же изоморфного ряда, число кислородных ионов должно быть одинаковым.
В классе силикатов наряду с изовалентным изоморфизмом широко распространены и явления гетеровалентного изоморфизма.
Классическим примером гетеровалентного изоморфизма является ряд плагиоклазов: Na[Si3AlO8]-Ca[Si2Al2O8]. Здесь Na1+ заменяется близким к нему по объему Ca2+. Происходящзе при этом увеличение положительного заряда на единицу сопровождается соответствующей заменой в радикале: один ион Si4+ заменяется ионом Al3+, или анион [SiO4]4- - анионом [AlO4]5-, т. е. происходит увеличение и отрицательного заряда на единицу.
Таким образом, как в этом, так и во многих других подобных примерах строго подтверждается, что компоненты, образующие изоморфные смеси, должны иметь:
- а) одно и то же число кислородных ионов, поскольку размеры элементарных ячеек мало меняются, и
- б) одинаковую общую валентность заменяемых и заменяющих ионов (Na1+Si4+ = Ca2+Al3+, Ca2+Si4+ = Na1+P5+ и т. д.), требуемую необходимым условием равенства положительных и отрицательных зарядов в кристаллической структуре.
Что касается количественных соотношений заменяемого и заменяющего ионов, то следует сказать, что, как правило, их числа равны. Однако, как мы увидим ниже, при описании минералов устанавливаются вполне оправдываемые исключения. Так, например, 3Mg2+ заменяются 2Al3+, 3Fe2+-2Fe3+ и др., причем общая валентность среди катионов сохраняется (в анионном радикале при этом не будет происходить каких-либо изменений). Следует подчеркнуть, что такого рода замены могут происходить лишь в определенных типах кристаллических структур. Наиболее благоприятные условия для такого рода замещений создаются в слоистых структурах силикатов.
Как и в других классах, среди силикатов распространены случаи ограниченной смесимости минеральных видов, а также явления распада твердых растворов.
Ограниченная смесимость изоструктурных, т. е. сходных по кристаллической структуре, соединений обусловливается значительной разницей в размерах заменяющих и заменяемых ионов. Например, давно установлено, что однотипные силикаты Ca и Mg легко дают двойные соединения (монтичеллит, диопсид и др.), ограниченно смешивающиеся со своими составными компонентами (конечными членами ряда), и притом в условиях высоких температур.
Лишь между Mg2[SiO3]2 и MgCa[SiO3]2 (клиноэнстатит-диопсид) существуют непрерывные изоморфные смеси в природных условиях, возникающие при высоких температурах.
Важной характеристикой структур силикатов являются также координационные числа, от которых зависят изоморфные замещения. Некоторые катионы имеют по два и даже по три таких числа. Ниже приведен список элементов, обычно распространенных в силикатах, и их координационных чисел, установленных в изученных кристаллических структурах:
B-4 Al-4,(5) и 6 Mn••-6 и 8 Ti-6 Si-4 Fe•••-4 и 6 Na-6 и 8 Zr-6 и 8 Be-4 Mg-6 и 8 Ca-6, 7 и 8 K-6 и 10 Zn-4 Fe••-6 и 8 Li-6 Ba-12
Как и следовало ожидать, координационные числа возрастают с увеличением радиусов ионов. Из приведенного списка можно также видеть, что Ti4+ и Zr4+ не встречаются в четверном окружении ионов кислорода и, следовательно, они не бывают заменителями Si4+ в кремнекислородных тетраэдрах. Поэтому прежние представления о "титаносиликатах" и "цирконосиликатах" оказываются с этой точки зрения неверными. Эти элементы в кристаллических структурах минералов принимают участие в качестве обычных катиснов, располагаясь в решетках между анионными радикалами. Однако для титана все же удалось показать, что лишь при сравнительно высоких температурах Ti4+ в значительной степени способен заменять Si4+ в пироксенах.
Что касается Fe3+, то этот элемент в ряде случаев входит в комплексный анион как заменитель Si4+ совершенно аналогично Al3+, со всеми вытекающими отсюда последствиями. Такие случаи установлены для ряда сильно железистых силикатов.
О классификации силикатов. В настоящее время, когда рентгенометрические исследования минеральных тел достигли значительных успехов, классификация силикатов, естественно, должна быть построена не только на основании их химических составов, но также с учетом типов кристаллических структур, рассмотренных выше.
Различные способы сочленений кремнекислородных тетраэдров накладывают совершенно определенный отпечаток как на химические формулы минералов и морфологические особенности их кристаллов, так и на многие физические их свойства (показатели преломления, двупреломление, удельные веса и т. д.)
Порядок расположения этих типов структур может быть различным. Одни авторы систематику силикатов строят в том порядке, как это мы рассмотрели выше: начиная от типа структур с изолированными кремнекисло-родными тетраэдрами и кончая каркасными структурами непрерывного протяжения в трехмерном пространстве. Другие принимают обратный порядок, причем систематика силикатов начинается с кварца, обладающего типичным каркасным строением решетки.
Мы остановимся на первом варианте, т. е. начнем с тех групп силикатов, которые отвечают типичным солям и являются наиболее простыми и близкими по своей конституции к минералам ранее рассмотренных классов кислородных солей. В отличие от них, класс силикатов разобьем на ряд подклассов.
Общая схема этого деления выразится в следующем виде:
- Подкласс А. Силикаты с изолированными тетраэдрами SiO4 в кристаллических структурах.
- Подкласс Б. Силикаты с изолированными группами тетраэдров SiO4 в кристаллических структурах.
- Тип 1. С изолированными группами Si2O7.
- Тип 2. С кольцевыми анионными радикалами SinO3n.
- Подкласс В. Силикаты с непрерывными цепочками тетраэдров SiO4 в кристаллических структурах.
- Тип 1. С одинарными цепочками.
- Тип 2. С двойными цепочками.
- Подкласс Г. Силикаты с непрерывными слоями тетраэдров SiO4 в кристаллических структурах.
- Подкласс Д. Силикаты с непрерывными трехмерными каркасами тетраэдров (Si,Al)O4 в кристаллических структурах. Такова схема деления силикатов на подклассы и типы.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'