
Глава II. Свойства минералов
1. Общие сведения
Когда мы осматриваем минералы в музейных витринах или лотках со специально подобранными образцами, то нас невольно поражает то разнообразие внешних признаков, по которым они отличаются друг от друга.
Одни минералы кажутся прозрачными (горный хрусталь, каменная соль), другие - мутными, полупрозрачными или совершенно не пропускающими свет (магнетит, графит).
Замечательной особенностью многих природных соединений служит их окраска. Для ряда минералов она постоянна и весьма характерна. Например: киноварь (сернистая ртуть) всегда обладает карминно-красным цветом; для малахита характерна яркозеленая окраска; кубические кристаллики пирита легко узнаются по металлически-золотистому цвету и т. д. Наряду с этим окраска большого количества минералов изменчива. Таковы, например, разновидности кварца: бесцветные (прозрачные), молочно-белые, желтовато-бурые, почти черные, фиолетовые, розовые.
Блеск - также весьма характерный признак многих минералов. В одних случаях он очень похож на блеск металлов (галенит, пирит, арсенопирит), в других - на блеск стекла (кварц), перламутра (мусковит). Немало и таких минералов, которые даже в свежем изломе выглядят матовыми, т. е. не имеют блеска.
Часто минералы встречаются в кристаллах, иногда очень крупных, иногда чрезвычайно мелких, устанавливаемых лишь с помощью лупы или микроскопа. Для ряда минералов кристаллические формы весьма типичны, например: для пирита - кубические кристаллы для гранатов - ромбические додекаэдры, для берилла - шестигранные призмы. Однако в большинстве случаев минеральные массы наблюдаются в виде сплошных зернистых агрегатов, в которых отдельные зерна не обладают кристаллографическими очертаниями. Многие минеральные вещества распространены также в виде натечных масс, иногда причудливой формы, ничего общего не имеющей с кристаллами. Таковы, например, почковидные массы малахита, сталактитоподобные образования лимонита (гидроокислов железа).
Минералы различаются и по другим физическим свойствам. Одни из них настолько тверды, что легко оставляют царапины на стекле (кварц, гранат, пирит); другие сами царапаются обломками стекла или острием ножа (кальцит, малахит); третьи обладают настолько низкой твердостью, что легко чертятся ногтем (гипс, графит). Одни минералы при раскалывании легко расщепляются по определенным плоскостям, образуя обломки правильной формы, похожие на кристаллы (каменная соль, галенит, кальцит); другие дают в изломе кривые, "раковистые" поверхности (кварц). Широко варьируют и такие свойства, как удельный вес, плавкость и др.
Столь же различны и химические свойства минералов. Одни легко растворяются в воде (каменная соль), другие растворимы лишь в кислотах (кальцит), третьи устойчивы даже по отношению к крепким кислотам (кварц). Большинство минералов хорошо сохраняется в воздушной среде. Однако известен ряд природных соединений, легко подвергающихся окислению или разложению за счет кислорода, углекислоты и влаги, содержащихся в воздухе. Давно установлено также, что некоторые минералы под воздействием света постепенно меняют свою окраску.
Все эти свойства минералов находятся в причинной зависимости от особенностей химического состава минералов, от кристаллической структуры вещества и от строения атомов или ионов, входящих в состав соединений. Многое, что раньше казалось загадочным, тепеРb, в свете современных достижений точных наук, особенно физики и химии, становится все более и более ясным.
В связи с этим вспомним некоторые важнейшие для нас положения физики, химии, кристаллохимии и коллоидной химии.
Агрегатные состояния минералов. Как уже указывалось, согласно существующим трем агрегатным состояниям вещества различают минералы твердые, жидкие и газообразные.
Любое вещество неорганической природы в зависимости от температуры и давления может находиться в любом агрегатном состоянии, а при изменении этих факторов переходит из одного состояния в другое.
Пределы устойчивости каждого агрегатного состояния находятся в самых различных температурных интервалах в зависимости от природы вещества. При атмосферном давлении в условиях комнатной температуры большинство минералов находится в твердом состоянии и плавится при высоких температурах, тогда как ртуть в этих условиях существует в жидком виде, а сероводород и углекислота-в газообразном состоянии.
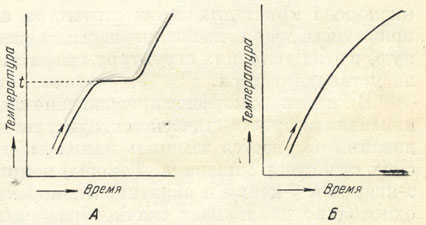
Рис. 5. Кривые нагревания кристаллического (А) и аморфного (Б) веществ
Большинство твердых минералов представлено кристаллическими веществами, т. е. веществами, обладающими кристаллической структурой. Каждое кристаллическое вещество имеет определенную температуру плавления, при которой изменение агрегатного состояния вещества происходит с поглощением тепла, что ясно сказывается на поведении кривых нагревания (рис. 5, А). На некотором интервале времени сообщаемый системе приток тепла расходуется на процесс плавления (кривая выполаживается).
Кристаллизация охлаждаемого гомогенного жидкого вещества должна происходить при той же температуре, что и плавление твердого тела того же состава, но обычно она наступает при некотором переохлаждении жидкости, что всегда необходимо иметь в виду.
Твердые химически чистые вещества, характеризующиеся беспорядочной структурой, т. е. отсутствием закономерного расположения атомов, носят название аморфных (стеклообразных) тел. Они принадлежат к числу изотропных веществ, т. е. обладающих по всем направлениям одинаковыми физическими свойствами. Характерной особенностью аморфных веществ, в отличие от кристаллических, является также постепенный переход одного агрегатного состояния в другое по плавной кривой (рис. 5, Б) подобно сургучу, который при нагревании постепенно становится гибким, затем вязким и, наконец, капельно-жидким.
Аморфные вещества часто получаются при затвердевании расплавленных вязких масс, особенно когда охлаждение расплава происходит очень быстро. Примером может служить образование минерала лешательерита - аморфного кварцевого стекла при ударе молнии в кварцевые кристаллические породы. Переход аморфных веществ в кристаллические массы может произойти лишь при продолжительном выдерживании их в размягченном состоянии при температуре, близкой к точке плавления.
Следует добавить, что далеко не все вещества могут быть легко получены в аморфном состоянии. Таковы, например, металлы, которые даже при закалке не образуют стеклообразных веществ.
Полиморфизм. Полиморфизмом ("поли" по-гречески - много) называют способность данного кристаллического вещества при изменении внешних факторов (главным образом температуры) претерпевать два или несколько видоизменений кристаллической структуры, а в связи с этим и изменений физических свойств. Наиболее ярким примером в этом отношении является диморфизм природного углерода, кристаллизующегося в зависимости от условий либо в виде алмаза (кубическая сингония), либо в виде графита (гексагональная сингония), очень сильно отличающихся друг от друга по физическим свойствам, несмотря на тождество состава. При нагревании без доступа кислорода кристаллическая структура алмаза при температуре выше 3000° при атмосферном давлении перестраивается в более устойчивую (стабильную) в этих условиях структуру графита. Обратный переход графита в алмаз не устанавливается.
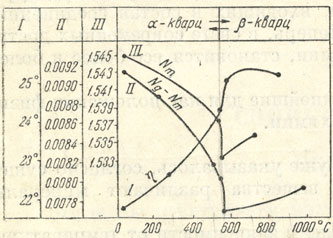
Рис 6. Изменение свойств кварца при нагревании. I - вращение плоскости поляризации; II - величина двупреломлепия; III - показатель преломления Nm (для линии D спектра)
Иногда полиморфное превращение сопровождается очень незначительным изменением кристаллической структуры вещества, и потому без тонких исследований не удается заметить каких-либо существенных изменений в физических свойствах минерала. Таковы, например, превращения так называемого α-кварца в β-кварц и обратно. Однако изучение оптических свойств (рис. 6) однозначно показывает скачкообразное изменение в точке перехода (около 573°) таких свойств, как показатели преломления, двупреломление и вращение плоскости оптической поляризации.
Устойчивые в тех или иных определенных физико-химических условиях разности данного кристаллического вещества называются модификациями, каждая из которых характеризуется определенной, ей свойственной кристаллической структурой. Таких полиморфных модификаций у какого-либо данного вещества может быть две, три или несколько (например, для серы установлено шесть модификаций, из которых в природе встречаются только три, для SiO2 - девять модификаций и т. д.).
Различные полиморфные модификации обычно обозначаются приставками к названию минерала греческих букв α, β, γ и т. д. (например: α-кварц, устойчивый ниже 573°; β-кварц, устойчивый выше 573°, и др.). В порядке наименования модификаций в литературе нет единообразия: одни придерживаются обозначения различных модификаций буквами α, β... в порядке повышения или понижения температуры превращения, другие порядок обозначений применяют по степени распространенности или в порядке открытия. Более рациональным следует считать первый порядок обозначения.
Явления полиморфизма весьма широко распространены среди природных соединений. К сожалению, они еще далеко не достаточно изучены. Полиморфные модификации различных минералов могут быть устойчивы в самых различных диапазонах изменения внешних факторов (температуры, давления и др.). Одни обладают широким полем устойчивости при весьма значительных колебаниях температуры и давления (алмаз, графит), другие, наоборот, претерпевают полиморфные превращения в узких пределах изменения внешних факторов (сера).
Самый факт перестройки кристаллической структуры при изменении внешних факторов равновесия, как полагает В. М. Гольдшмидт, обусловливается не тем, что при этом меняются межатомные или межионные расстояния, а тем, что происходят сильные изменения во взаимной поляризации структурных единиц, удерживаемых в решетке электростатическими силами. В простейшем случае в момент критического состояния происходит изменение координационного числа, свидетельствующее о коренном изменении строения вещества.
Нередко бывает, что высокотемпературная модификация какого-либо минерала при превращении в более низкотемпературную модификацию сохраняет внешнюю форму первоначальных кристаллов. Такие случаи ложных форм носят название параморфоз. Примером могут служить параморфозы кальцита по арагониту (CaCO3).
Если данная модификация кристаллического вещества, допустим α, обладает свойством при изменении внешних условий (например температуры) переходить в другую - β-модификацию, а при восстановлении прежних условий превращается обратно в α-модификацию, то такие полиморфные превращения называются энантиотропными*. Пример: превращение ромбической α-серы в моноклинную β-серу и обратно. Если же обратный переход не может совершаться, то такой вид превращения носит название монотропного. Примером может служить монотропное превращение ромбического арагонита (CaCO3) в тригональный кальцит (при нагревании).
*("Энантиос" по-гречески - противоположный, "тропос" - перемена, преобразование)
В природе нередко наблюдается одновременное существование в одних и тех же физико-химических условиях двух модификаций даже рядом друг с другом (например: пирита и марказита, кальцита и арагонита и др.). Очевидно, переход одной из модификаций в стабильную, т. е. устойчивую, в силу каких-то причин задержался, и вещество в таком случае находится в метастабильном (или, как иначе называют, лабильном, инстабильном) состоянии, подобно тому как существуют переохлажденные жидкости.
Следует подчеркнуть, что устойчивая модификация по сравнению с неустойчивой обладает:
- меньшей упругостью пара,
- меньшей растворимостью и
- более высокой температурой плавления.
Явления разрушения кристаллических решеток. Главнейшими особенностями пространственных решеток кристаллических тел являются закономерное расположение и строго уравновешенное состояние слагающих их структурных единиц. Однако, достаточно создать такие условия, при которых внутренние связи структурных единиц будут поколеблены, как из кристаллического вещества с упорядоченной пространственной решеткой мы получим аморфную массу, не обладающую кристаллическим строением.
Прекрасным примером в этом отношении является минерал ферробрусит - (Mg,Fe)[OH]2, содержащий в виде изоморфной примеси до 36% (по весу) закиси железа. В свежем состоянии этот минерал, будучи извлечен из глубоких горизонтов шахт, совершенно бесцветен, прозрачен и обладает стеклянным блеском. В течение нескольких дней его кристаллики на воздухе постепенно меняют свой цвет, становясь золотисто-желтыми, затем бурыми и, наконец, непрозрачными темнокоричневыми, сохраняя внешнюю кристаллическую форму*. Химический анализ показывает, что почти все двухвалентное железо при этом переходит в трехвалентное (т. е. происходит окисление), а рентгенометрическое исследование не устанавливает признаков кристаллического строения. Очевидно, окисление железа нарушило внутренние связи в кристаллической решетке, что и привело к дезорганизации строения вещества.
*(Брусит, не содержащий железа, в аналогичных условиях вполне устойчив)
То, что происходит с ферробруситом в окислительной обстановке при комнатной температуре и атмосферном давлении, для других минералов может иметь место при повышенных температурах и давлениях, как это уже установлено для ряда случаев.
Весьма интересные явления изучены в минералах, содержащих редкоземельные и радиоактивные элементы (ортит, фергюсонит, эшинит и др.). В них также очень часто, но не всегда, устанавливается превращение кристаллического вещества в аморфное, которое, как предполагают, обязано действию α-лучей при радиоактивном распаде*. Эти измененные стеклообразные минералы, не относящиеся к кубической сингонии, оптически изотропны и не обнаруживают дифракции рентгеновских лучей, т. е. ведут себя как аморфные тела. При этом происходит частичная гидратация вещества. Такие тела Брёггер назвал метамиктными.
*(По В. М. Гольдшмидту, для достижения аморфного состояния в этих случаях не достаточно одной радиоактивности минерала, а необходимы также следующие два условия:
- первоначально возникающее кристаллическое вещество должно обладать слабой ионной решеткой, допускающей перегруппировку или гидролиз; такие решетки образуются преимущественно при соединении слабых оснований со слабыми ангидридами;
- решетка должна содержать один или несколько сортов ионов,способных легко перезаряжаться (например, ионы редких земель) или даже превращаться в нейтральные атомы (например, образование атомарного фтора в флюорите под влиянием радиоактивного излучения со стороны)
Сам процесс распада В. М. Гольдшмидт представляет как перегруппировку вещества. Например, соединение YNbO4 превращается в тонкодисперсную смесь (твердый псевдораствор) окислов: Y2O3 и Nb2O5. При такой концепции понятно, почему не наблюдается превращений в аморфное вещество простых соединений, как ThO2 (торианит), или солей сильных кислот со слабыми основаниями, например (Ge, La...) PO4 (монацит))
В подтверждение явлений распада кристаллических сред можно привести и ряд других аналогичных примеров, иллюстрирующих образование аморфных или коллоидных масс. Однако нельзя думать, что эти новообразования являются устойчивой формой существования вещества. Известно не мало примеров вторичной перегруппировки вещества с образованием новых кристаллических тел, устойчивых при изменившихся условиях. Так, известны "кристаллы ильменита" (Fe..TiO3), которые при микроскопическом изучении оказываются состоящими из смеси двух минералов: гематита (Fe2O3) и рутила (TiO2). Повидимому, после момента образования ильменита в какой-то период жизни минерала, под влиянием изменившегося режима кислорода, создались резко окислительные условия, приведшие к переходу Fe2+ в Fe3+ с одновременным распадом кристаллической структуры, а затем к постепенной перегруппировке вещества с образованием смеси устойчивых минералов. Точно так же, например, наблюдались случаи образования на месте тиллита (PbSnS2), галенита (PbS) и касситерита (SnO2) в теснейшем прорастании друг с другом, но при сохранении реликтового (т. е. прежнего) пластинчато-зернистого строения агрегата, характерного для тиллита. Очевидно, в связи с увеличившейся в какой-то момент концентрацией кислорода в данной среде, олово, обладая большим сродством с кислородом, обособилось из первоначально гомогенной минеральной массы в виде окисла, а свинец перешел в форму самостоятельного сернистого соединения.
Понятие о коллоидах*. Кроме явно-кристаллических образований, кристаллическая природа которых легко устанавливается на глаз или под микроскопом, в земной коре широким распространением пользуются также коллоиды.
*("Колла" по-гречески - клей, "коллоид" - клееподобный)
Коллоидами называются гетерогенные (разнородные) дисперсные* системы, состоящие из "дисперсной фазы" и "дисперсионной среды".
*(Дисперсия - рассеяние; в данном случае - состояние вещества в виде мельчайших частиц. Степень дисперсности определяется величиной этих частиц)
Дисперсная фаза в этих системах представлена тонко распыленными частичками (мицеллами) какого-либо вещества в какой-либо массе (дисперсионной среде). Размеры частичек дисперсной фазы колеблются в пределах приблизительно от 100 до 1 mμ (от 10-4 до 10-6 мм), т. е. много крупнее, чем размеры ионов и молекул, но в то же время настолько малы, что с помощью обычного микроскопа не различимы. В каждой такой частичке может содержаться от нескольких до многих десятков и сотен молекул данного соединения; в твердых частичках ионы или молекулы связаны в кристаллическую решетку, т. е. эти частички представляют собой мельчайшие кристаллические фазы.
Агрегатное состояние дисперсной фазы и дисперсионной среды может быть различным (твердым, жидким, газообразным), причем могут наблюдаться самые различные их комбинации. Обозначая заглавными буквами агрегатное состояние дисперсионной среды, а малыми буквами состояние дисперсной фазы, приведем следующие примеры:
- Г + т: табачный дым; сажа
- Г + ж: туман
- Ж + т: желтые торфяные воды; лечебные грязи
- Ж + г: сероводородные источники; пена
- Ж + ж: типичные эмульсоиды (например, молоко)
- T + ж: кристаллы самородной серы с распыленными в них жидкими битумами; опал
- T + т: красный кальцит с тонко распыленной в нем окисью железа
- T + г: минералы молочно-белого цвета, содержащие газы
Среди коллоидных образований различают золи и гели.
Типичные золи, иначе называемые коллоидными растворами или псевдорастворами, представляют собой такие образования, в которых дисперсионная среда сильно преобладает над дисперсной фазой (например: табачный дым, желто-бурые железистые воды, молоко). На глаз такие растворы кажутся совершенно однородными и часто прозрачными, неотличимыми от истинных (ионных или молекулярных) растворов. В золях, в которых дисперсионная среда ("растворитель") представлена водой, частички дисперсной фазы легко проходят через обыкновенные фильтры, но не проникают через животные перепонки. Если размер их превышает 5 mμ, то их легко удается обнаружить в ультрамикроскопе с помощью так называемого светового конуса Тиндаля, который создается при боковом освещении специального стеклянного сосуда, наполненного коллоидным раствором. Создаваемый при этом эффект совершенно аналогичен тому, что мы обычно наблюдаем в затемненной комнате в пучке света, исходящего из проекционного фонаря: в светящемся конусе становятся видимыми частички дисперсной фазы, совершающие броуново движение, чего никогда не наблюдается в истинных растворах, за исключением растворов некоторых органических соединений с очень крупными молекулами.
В гелях дисперсная фаза представлена в столь значительном количестве, что отдельные дисперсные частички являются как бы слипшимися между собой, образуя студнеобразные, клееподобные, стекловидные массы. Дисперсионная среда в этих случаях как бы занимает оставшееся пространство между дисперсными частичками Примерами гелей могут служить: сажа, грязь, опал (гель кремнезема), лимонит (гель гидроокислов железа) и др.
В зависимости от природы дисперсионной среды различают: гидрозоли и гидрогели (дисперсионная среда - вода), аэрозоли и аэрогели (дисперсионная среда - воздух), пирозоли и пирогели (дисперсионная среда - какой-либо расплав), кристаллозоли и кристаллогели (дисперсионная среда - какое-либо кристаллическое вещество) и т. д.
Наибольшее распространение в земной коре имеют гидрозоли, кристаллозоли и гидрогели. Дальше мы будем говорить только о них.
Гидрозоли наиболее просто могут быть получены механически, путем тонкого распыления тем или иным путем вещества до размеров дисперсной фазы в воде. В природе грубо- и тонкодисперсные системы нередко образуются при перетирании и истирании горных пород и минералов под влиянием движущих сил (водных потоков, ледников, тектонических смещений и пр.).
Однако наибольшую роль в образовании природных коллоидных растворов играют химические реакции в водных средах, приводящие к конденсированию молекул: окисление, восстановление и, особенно, реакции обменного разложения. Для самой поверхностной части земной коры не меньшее значение в образовании коллоидов имеет также жизнедеятельность организмов (биохимические процессы).
Важно отметить, что дисперсные частички в коллоидных растворах электрически заряжены, в чем легко убедиться при пропускании через растворы электрического тока. Знак заряда одинаков для всех частиц данного коллоида, благодаря чему, отталкиваясь друг от друга, они находятся во взвешенном состоянии в дисперсионной среде. Возникновение заряда объясняют адсорбцией дисперсными частичками тех или иных ионов, содержащихся в растворах. На этом вопросе необходимо остановиться более детально.
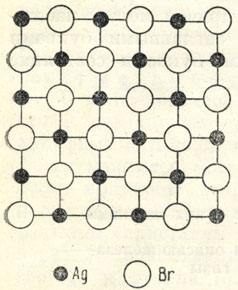
Рис. 7. Сечение кристаллической решетки AgBr
Представим себе, для примера, твердую дисперсную частичку AgBr. Несмотря на ультрамикроскопические размеры, она должна обладать кристаллической структурой, которая схематически в разрезе изображена на рис. 7. Каждый из катионов Ag1+ и анионов Br1- внутри этой решетки находится в шестерном окружении ионов противоположного заряда: четырех - в плоскости чертежа, одного - над данным ионом и одного - под ним. Таким образом, внутренние ионы дисперсной частички полностью насыщены валентностями. Иначе обстоит дело с пограничными ионами в кристаллической решетке. Тем же путем легко подсчитать, что большинство наружных ионов на грани, перпендикулярной к плоскости рисунка, получает насыщение только от пяти ионов противоположного знака (трех - в плоскости рисунка, одного - над и одного - под плоскостью рисунка). Следовательно, ионы Ag и Br, расположенные на плоской поверхности дисперсной частички, имеют по 1/6 ненасыщенной валентности, а на ребрах по 2/6, а угловые ионы - даже по 3/6 ненасыщенной валентности. Этот остаточный некомпенсированный заряд и обусловливает поглощение (адсорбцию) из раствора некоторого количества дополнительных ионов брома или серебра, удерживающихся у поверхности дисперсных частиц в виде так называемого диффузного слоя.
Практически коллоид AgBr получается путем смешения растворов AgNO3 и KBr, реагирующих по следующей схеме: AgNO3 + KBr = AgBr + KNO3. Если эти растворы смешать в эквивалентных количествах, то образуется кристаллический осадок AgBr (но не коллоид). Если азотнокислое серебро вливать в бромистый калий, то возникает золь, дисперсные частички которого AgBr заряжаются отрицательно благодаря адсорбции ионов Br1-. При обратном порядке сливания образующиеся дисперсные частички AgBr адсорбируют катионы Ag1+ и заряжаются вследствие этого положительно.
Чтобы получить более реальное представление о гидрозолях и строении дисперсных фаз, обратимся к характеристике их с точки зрения электрохимии.
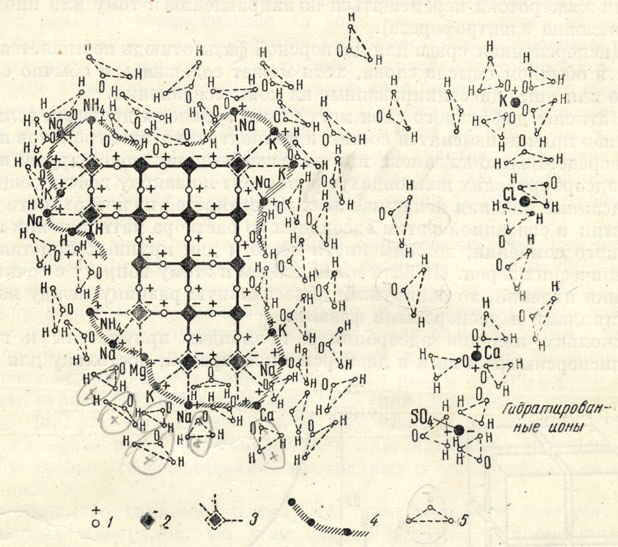
Рис. 8. Схема строения дисперсной фазы в водной среде, содержащей электролиты. 1 - катионы в кристаллической решетке дисперсной фазы; 2 - анионы в ней; 3 - выступающие на углах анионы с ненасыщенными валентностями; 4 - адсорбированные катионы ионного роя; 5 - диполи H2O (частично деформированные)
На рис. 8 схематически изображена коллоидная частица в окружении дисперсионной среды, в данном случае воды, содержащей ионы Na1+, K1+, Ca2+, Mg2+, Cl1-, [SO4]2- и другие, обычно встречающиеся в почвенных водах, которые содержат то или иное количество растворенных солей. Сама дисперсная частичка, так же как и в предыдущем случае, показана в виде кристаллической фазы, у которой в угловых точках должна иметь место неполная насыщенность валентностями. Следовательно, у этих выступов будут скопляться адсорбируемые ионы, в нашем случае катионы Na1+, K1+, NH41+, Mg2+, Ca2+, заряжающие дисперсную частичку положительно и образующие диффузный слой.
Выступающие по углам решетки анионы оказывают свое влияние не только на ионы, находящиеся в растворе, но также и на электрически нейтральные молекулы воды. Как мы потом узнаем, молекула H2O представляет собой диполь и имеет оригинальное строение. Ее можно представить в виде одного иона кислорода О2-, отрицательный заряд которого нейтрализован двумя внедренными в него протонами H1+. Оба протона располагаются на одной стороне (от центра иона кислорода), которая заряжена положительно, а противоположная ей - отрицательно. Такое строение молекулы H2O позволяет ей ориентироваться определенным образом (рис. 8): стороной, противоположной двум протонам H1+, она притягивается к катионам. Поскольку нейтральные электрически молекулы H2O не нейтрализуют влияющего на них заряда катионов, постольку этот заряд распространяется и дальше-на следующие ближайшие молекулы H2O, так же ориентирующиеся.
Таким образом, вокруг дисперсной частички устанавливается целый рой ионов и ориентированных молекул H2O (рис. 8). Толщина водной оболочки зависит от рода гидратируемых катионов (удерживающих молекулы H2O). Наиболее сильно гидратируются катионы щелочных металлов. Например, ион Na1+ в водной среде способен удерживать 60-70 ориентированных молекул H2O, тогда как Ca2+-всего лишь до 14 молекул H2O.
Следует также заметить, что в некоторых случаях при воздействии кислот катионы диффузного слоя могут быть заменены анионами, например: Cl1-, [SO4]2- и др. Последние, так же как и катионы, могут быть гидратированными; однако ориентировка молекул воды при этом будет обратная тому, что имеет место для катионов (см. правую часть рис. 8).
Из всего сказанного можно сделать следующие выводы:
- Заряженную дисперсную фазу с электрохимической точки зрения можно считать крупным ионом ("макроионом"), способным в золях при пропускании электротока перемещаться по направлению к тому или иному электроду (явление электрофореза).
- Дисперсионная среда для дисперсной фазы отнюдь не является растворителем в обычном смысле слова, хотя может содержать и обычно содержит в себе те или иные диссоциированные на ионы соединения.
- Катионы диффузного слоя могут быть заменены другими, если в силу каких-либо причин изменятся состав и концентрация электролитов в дисперсионной среде. Взаимная замена или вытеснение одних ионов другими в адсорбентах (адсорбирующих коллоидах) происходят по закону действующих масс.
Описанные явления ненасыщенных валентностей на поверхности дисперсных частиц и связанной с этим адсорбции из раствора катионов или анионов, вне всякого сомнения, должны иметь место и для крупных кристаллов или кристаллических зерен. Но если мы подойдем к этому вопросу с точки зрения энергетики явлений, то обнаружим колоссальную разницу между настоящими кристаллами и дисперсными фазами.
Поскольку явления адсорбции в коллоидах приурочены к границам между дисперсными фазами и дисперсионной средой, постольку для выражения суммарной поверхности энергии вещества весьма важное значение имеет общая поверхность дисперсных частиц в единице объема. Эта поверхность, называемая удельной поверхностью, резко возрастает по мере увеличения степени дисперсности вещества. Это нетрудно показать.
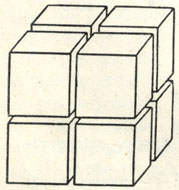
Рис. 9. Куб, разделенный на восемь кубиков
Допустим, что мы имеем кубический кристалл какого-либо минерала с ребром, равным 1 см. Его общая поверхность будет равна 6 см2 (удельная поверхность-6). Если этот куб мы поделим на восемь частей, как показано на рис. 9, то общая поверхность полученных восьми мелких кубиков будет равна уже 12 см2, а при делении на кубики с ребром в 1 мм-60 см2. Если мы дальнейшее деление доведем до кубиков с ребром в 1 mμ, т. е. до размера коллоидной дисперсной фазы, то общая поверхность достигнет огромной величины 6000 м2 при общем объеме массы в 1 см3 (т. е. удельная поверхность будет равна 6•107). При этом число кубиков достигнет цифры 1021.
Таким образом, между удельной поверхностью х и размером зерен у мы имеем обратно пропорциональную зависимость, выражающуюся простой формулой: х = 6/y . Эту зависимость легко изобразить в виде графика (рис. 10).
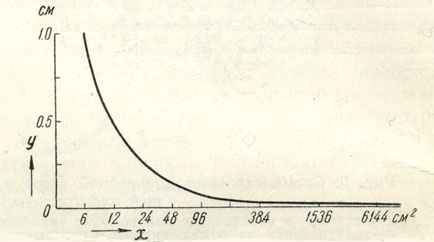
Рис. 10. Зависимость между размерами зерен (у) и удельной поверхностью (х)
Из приведенных данных видно, что для крупнокристаллических систем удельная поверхность, а следовательно и связанная с ней поверхностная энергия имеют настолько ничтожное значение, что последней практически можно пренебречь. Наоборот, в коллоидных системах она приобретает исключительное значение. Именно благодаря этому целый ряд физических и химических свойств коллоидных образований, широко используемых для практических целей, весьма сильно отличается от свойств грубокристаллических веществ.
Явления диффузии в коллоидных растворах проявляются несравненно слабее, чем в истинных растворах, что объясняется гораздо большей величиной частиц дисперсной фазы по сравнению с ионами. Это обстоятельство сказывается в том, что образующиеся из коллоидных растворов минеральные массы обладают часто крайне неоднородными составом и строением.
Кристаллозоли, т. е. типичные кристаллические среды, содержащие в себе в виде дисперсной фазы какое-либо вещество, часто образуются в результате кристаллизации гидрозолей. Процесс их образования можно сравнить с кристаллизацией (превращением в лед) мутной воды, т. е. воды, содержащей во взвешенном состоянии дисперсные частички. Образовавшийся лед также будет мутным, т. е. загрязненным той же дисперсной фазой, которая присутствовала и в воде. Иначе говоря, он будет представлять собой кристаллозоль.
Сюда прежде всего относятся многие, окрашенные в тот или иной цвет минералы, обычно наблюдающиеся в виде бесцветных прозрачных кристаллов. Таковы, например, красноватый карналлит, красный барит (благодаря содержанию в виде дисперсной фазы окиси железа), черный кальцит, цвет которого в одних случаях обусловлен тонко распыленными в нем сульфидами, в других - органическими веществами, и т. д. Сюда же должны быть причислены молочно-белый кварц, кальцит и др., в которых роль дисперсной фазы играют тонкораспыленные газы или жидкости, часто видимые в тонких шлифах под микроскопом. Встречаются кристаллы, например кварца, кальцита и других минералов, с кристаллически-зональным строением, обусловленным чередованием прозрачных и окрашенных или молочно-белых зон.
Нет никакого сомнения в том, что кристаллозоли имеются и среди непрозрачных минералов. Об этом свидетельствуют улавливаемые химическим и спектральным анализами примеси таких элементов, которые невозможно объяснить с кристаллохимической точки зрения как результат изоморфных примесей. Таковы, например, факты содержания меди в кристаллах пирита, золота в пирите, галените, арсенопирите и др. Микроскопическими исследованиями полированных шлифов, приготовленных из таких кристаллов, при больших увеличениях часто удается обнаружить мельчайшие включения халькопирита, самородного золота и др., наводящие на мысль о том, что в них, вероятно, присутствуют и более тонкодисперсные частички, не улавливаемые с помощью обычных микроскопов*.
*(Разрешающая способность (предел различимости) современных обычных микроскопов составляет 0,5-1,0 μ. Более мелкие частички совершенно не улавливаются ни ори каких увеличениях)
Гидрогели в природных условиях часто образуются из гидрозолей путем свертывания или, как говорят, их коагуляции, выражающейся в образовании сгустков в водной среде. Процесс коагуляции наступает только в том случае, когда, в силу тех или иных причин, дисперсные частички теряют свой заряд, становясь электрически нейтральными. В этом случае исчезают силы отталкивания частиц друг от друга, происходит соединение частиц в более крупные тельца, называемые полиионами, с последующим оседанием их под действием силы тяжести.
Нейтрализация зарядов дисперсных частиц, вызывающая коагуляцию, может быть получена различными способами:
- а) прибавлением к коллоидному раствору электролитов (ионных растворов), причем в зависимости от заряда дисперсной фазы нейтрализация будет производиться анионами или катионами электролита; таким путем образуются многие илистые осадки в устьях больших рек, выносящих коллоидные растворы; последние при встрече с морскими водами, содержащими растворенные соли, которые играют роль электролитов, подвергаются коагуляции и осаждению в прибрежных зонах морских бассейнов;
- б) путем взаимной нейтрализации коллоидных растворов, содержащих противоположно заряженные коллоидные частички и взятых в соответствующих количественных отношениях; в результате этого получаются смешанные гели (например, богатые коллоидным кремнеземом бурые железняки);
- в) путем самопроизвольной коагуляции коллоидных растворов с течением времени, особенно если в системе происходит потеря дисперсионной среды (воды) вследствие ее испарения; при этом происходит, естественно, и увеличение концентрации электролитов, содержащихся в коллоидных растворах; примером являются илистые осадки и грязи в высыхающих озерах;
- г) при циркуляции коллоидных растворов по капиллярам в горных породах; вследствие высокой диэлектрической постоянной воды смачиваемые стенки капилляров заряжаются отрицательно ионами [ОН]1-, что обусловливает выпадение из циркулирующих коллоидных растворов положительно заряженных частиц в виде хлопьев или налетов; примером может служить часто наблюдающееся "ожелезнение" известняков и других пород, выражающееся в окрашивании породы с поверхности или по трещинам хлопьевидными гидроокислами железа в бурый цвет;
- д) при процессах метасоматоза (замещения) тех или иных горных пород, легко реагирующих с химически активными растворами солей с образованием коллоидных растворов, тут же коагулирующих (например, образование малахита за счет купоросных вод в известняках), и т. д.
В области биосферы широко распространены гели органического происхождения. Образование гелей в ряде случаев связано с жизнедеятельностью бактерий. Например, установлено, что так называемые железобактерии, перерабатывая илистые озерные осадки, постепенно отлагают коллоидные гидроокислы железа (лимонит).
Коллоиды, в которых дисперсные частички обладают способностью облекаться с поверхности слоем молекул воды, называют гидрофильными, а в противном случае - гидрофобными. Гидрофильные коллоиды по сравнению с гидрофобными значительно труднее подвергаются коагуляции. В случае коагуляции гидрофильных коллоидов обычно образуются слизистые, клееподобные, желатинообразные гелевые осадки.
Из гидрофобных же коллоидных растворов чаще всего образуются гели в виде порошковатых и хлопьевидных масс.
Гели, особенно те, что возникают из гидрофильных коллоидов, с течением времени легко теряют воду (дисперсионную среду), т.е. подвергаются дегидратации. Богатые водой гидрогели в момент возникновения обладают почти жидкой консистенцией. По мере испарения дисперсионной среды при стоянии на воздухе они становятся более упругими и, наконец, твердыми и хрупкими. Однако полностью вода может быть удалена лишь путем прокаливания.
Некоторые гели при прибавлении дисперсионной среды способны не только набухать (подобно желатину), но и вновь переходить в золи. Этот процесс превращения гелей в золи называется пептизацией. Такие гели носят название обратимых и широко представлены среди органического мира. Зато почти все неорганические коллоидные образования принадлежат к числу необратимых, т. е. не переходящих в золь, гелей.
Явление адсорбции в гелях, разумеется, сохраняет свое значение. При этом во многих случаях имеет место селективная, т. е. избирательная, адсорбция. Например, глинистые вещества обладают способностью адсорбировать преимущественно катионы калия и радиоактивных элементов, а гель двуокиси марганца - катионы Ba, Li, К (но не адсорбирует анионов) и т. д.
Таким образом, коллоиды, как мы видели, существенно отличаются по своим свойствам как от истинных растворов, так и от грубодисперсных систем (с частицами, более крупными, чем 100 mμ). В коллоидах на первое место выступают не векториальные свойства кристаллических решеток, не силы химического сродства, а огромная поверхностная энергия и связанные с ней электрические силы. Тем не менее между коллоидными и истинными растворами имеются постепенные переходы, точно так же как существуют постепенные переходы и к грубым дисперсиям.
В. Оствальд дал следующую схему дисперсных систем:

Схема дисперсных систем В. Оствальда
Эта схема одинаково должна быть отнесена как к жидким, так и к твердым системам.
В настоящее время точно установлено, что "коллоидное состояние есть общее состояние материи" (Веймарн), т. е. любое вещество может быть получено в виде коллоида. Важно подчеркнуть, что коллоиды могут образоваться при самых различных температурах и давлениях и в самых разнообразных условиях.
Со строго теоретической точки зрения коллоиды не могут рассматриваться как самостоятельные особые минералы, так как они представляют собой по существу механические смеси различных веществ (дисперсной фазы и дисперсионной среды). Однако по чисто внешним признакам, т. е. макроскопически, они совершенно не отличимы от типичных минералов. Не удается установить различий между ними и минералами в строгом смысле слова также путем доступных нам микроскопических методов исследования. Поэтому в курсах описательной минералогии коллоидные образования условно рассматриваются наряду с типичными минералами.
Раньше твердые коллоиды (гели) относились к числу аморфных минералов, поскольку они не наблюдаются в виде явнокристаллических образований (если не принимать во внимание кристаллозоли). Однако рентгенометрические исследования этих веществ часто показывают, что они представляют собой скрытокристаллические вещества и поэтому не могут относиться к типичным аморфным гомогенным телам, несмотря на то что внешне очень похожи.
О перекристаллизации гелей. Установлено, что гидрогели, образующиеся в результате коагуляции, с течением времени подвергаются старению, т. е. постепенному изменению их состава и строения. Это изменение прежде всего выражается в том, что вещество постепенно теряет воду, т. е. подвергается дегидратации (обезвоживанию).
Таковы, например, широко распространенные в природе гидрогели кремнезема - опалы. Богатые водой гидрогели кремнезема имеют консистенцию полужидких масс-студней. При постепенной потере воды они становятся все более и более твердыми, стекловидными или полуматовыми в изломе. Именно так выглядят встречающиеся в природе опалы, в большинстве случаев бедные водой. Эти образования характеризуются незаметной на глаз и под микроскопом тончайшей пористостью, которая может быть установлена лишь при окрашивании их какими-либо органическими веществами. Остающаяся в них вода может быть удалена лишь при нагревании.
В случае сильного проявления дегидратации в богатых водой гелях возникает заметная на глаз пористость, а иногда наблюдается сморщивание массы или появление характерных трещин усыхания в виде сеток подобно тому, как это часто бывает при высыхании грязи в лужах.
Исследование типичных твердых и полутвердых гелей с помощью рентгеновских лучей методом Дебая-Шеррера показывает, что многие из них не дают интерференционных полос, тогда как состарившиеся коллоидные образования обнаруживают явнокристаллическое строение вещества. В ряде случаев в этом можно убедиться и при изучении таких гелей под микроскопом. Таковы, например, многие сталактитовые образования углекислого кальция. На месте опалов (твердых гидрогелей кремнезема) в результате перекристаллизации образуются скрытокристаллические агрегаты безводного халцедона или кварца. Примерами могут служить кремни и агаты. Гели, перешедшие в кристаллически-зернистые агрегаты, получили название метаколлоидов (бывших коллоидов).
Сущность перекристаллизации гелей выражается в объединении беспорядочно ориентированных дисперсных фаз в более крупные единицы с единой кристаллической решеткой. Это явление известно под названием собирательной кристаллизации. В ней выражается закономерная тенденция веществ принимать состояние с наименьшей удельной поверхностью и, следовательно, с наименьшей поверхностной энергией.
При этом часто, особенно в почковидных гелевых массах, возникают тонковолокнистые агрегаты с радиальным расположением индивидов, хорошо наблюдаемым на изломе. На периферических частях корок, шаровидных и почковидных образований для некоторых минералов в этих случаях бывают характерны кристаллические грани, которыми оканчиваются радиально растущие индивиды.
Факторы, влияющие на перекристаллизацию гелей, разнообразны. Наиболее существенное значение имеют температура и давление, повышение которых ускоряет процесс перекристаллизации. Несомненную роль играют также климатические условия: в районах с сухим и жарким климатом дегидратация и перекристаллизация гидрогелей, образующихся на поверхности, гораздо сильнее выражены по сравнению с районами, характеризующимися умеренным и влажным климатом. Бесспорное значение имеет, конечно, время, с течением которого в самых различных геологических условиях происходит постепенное превращение гелей в явнокристаллические агрегаты.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'