
Рождение кристаллов
Родная стихия минералов
Наблюдать природную кристаллизацию удается нечасто. Но можно судить о ней по заслуживающим доверия косвенным данным, а также по тому, что известно о выращивании искусственных кристаллов. Лаборатория или завод, где создаются такие кристаллы, может до некоторой степени служить моделью природного кристаллообразования - в принципе минералы образуются теми же способами. Правда, искусственные кристаллы выращиваются при специально подобранных режимах и в специальных кристаллизаторах - изложницах, автоклавах, лабораторных сосудах. Минералы же растут в самых разных вместилищах - водоемах, полостях и трещинах горных пород и т. д., стенки которых сложены бесчисленными ранее образовавшимися индивидами. Последнее обстоятельство весьма существенно. На кристаллизацию сильно влияют и "посторонние" вещества, которые почти всегда присутствуют в минералообразующей среде. И, наконец, обстановка минералообразования динамична и переменчива. За тот долгий срок, что растут природные кристаллы, могут изменяться в широких пределах и неоднократно температура и давление, состав и концентрация среды кристаллизации - т. е. по существу все факторы, определяющие ход процесса. Этапы спокойной эволюции минерального индивида сменяются резкими скачками. Все это, конечно, не может не сказаться на внешности конечного продукта - природного кристалла.
В образовании минералов исключительная роль принадлежит универсальному и вездесущему природному растворителю - воде. Именно водный раствор чаще всего служит минералообразующей средой; он содержит в растворенном виде либо сам минерал, либо те вещества, из которых минерал образуется в ходе какой-нибудь химической реакции.
Читатель может отнестись к этому утверждению скептически: широко известно, что вода минералы "не берет". Правда, не все: гипса в 1 л воды растворяется до 2 г, а галита даже до 350 г. Но эти и немногие другие исключения не меняют общего правила: в большинстве своем минералы в воде нерастворимы. Точнее говоря, почти нерастворимы, что, впрочем, не меняет дела.
Все это верно, но только в обычных, "комнатных" условиях. Минералы же часто образуются в глубоких недрах Земли, где господствуют совсем другие условия - высокие давления и температуры, а вода практически всегда содержит "сорастворенные" химически активные примеси. И это резко увеличивает растворимость минералов. Так, если в 1 л воды в комнатных условиях можно растворить не более 0,004 г кварца, то при 350°С - уже 2,5 г, а в щелочных растворах - даже до 70 г. Из таких растворов могут вырастать кристаллы значительных размеров, и занимает это не так уж много времени. Например, кристалл кварца может достигнуть длины 10-15 см всего за несколько месяцев (хотя в иной природной обстановке для этого может потребоваться гораздо больше времени). Растворимость других минералов тоже в той или иной мере увеличивается в экстремальных условиях недр Земли.
Диапазон минералообразования из водных растворов огромен: гигантские залежи галита, гипса, боратов, возникшие в поверхностных водоемах, и промышленные гидротермальные месторождения, образовавшиеся на значительных глубинах при температурах в сотни градусов и давлениях, превышающих атмосферное в сотни и тысячи раз; отдельные крохотные кристаллики в зонах окисления рудных месторождений и колоссальные сооружения карстовых пещер. Кристаллизация из водных растворов охватывает по меньшей мере 90% минеральных видов.
Минералы кристаллизуются также из расплавов, газов и паров. Расплавы обычно имеют глубинное происхождение, температура их может достигать 1500°С, а давление превышает атмосферное в тысячи раз. Кристаллизация происходит по мере остывания расплава, оказавшегося в верхних, более холодных зонах Земли. Если остывание идет медленно, вырастают крупные кристаллы. Так бывает, когда большие массы расплава остывают на значительной глубине - это может продолжаться многие тысячи и даже миллионы лет. При вулканических извержениях расплав изливается на земную поверхность, вследствие чего он быстро остывает. В этом случае образуется множество микроскопических кристаллов или однородная стекловидная масса. Из расплавов кристаллизуется не более 20% минеральных видов, но на их долю приходится свыше 90% массы земной коры. Сюда относятся такие породообразующие минералы, как оливин, слюды, пироксены, кварц, нефелин, многие промышленно важные минералы - хромит, пентландит и др. Большинство минералов, кристаллизующихся из расплавов, образуется также из природных водных растворов.
Из газов и паров - главным образом вулканического происхождения - кристаллизуется не более 2,5% минеральных видов. Некоторые из них - сера, нашатырь, борная кислота - образуют промышленные месторождения. Температура кристаллизации может достигать 1000°С, процесс идет быстро, и в отдельных случаях выпадает возможность наблюдать его собственными глазами. Так, в 1817 г. немецкий минералог И. Ф. А. Брейтгаупт сделал сенсационное сообщение об образовании всего за 10 дней метровой толщи гематита, наблюдавшемся им при извержении Везувия.
Кристаллизация в твердой среде - явление редкое. Формально сюда относят и так называемые метакристаллы, образовавшиеся в проницаемой и податливой горной породе (например, метакристаллы пирита в сланце). Метакристаллы растут за счет питания из тонкой пленки раствора, расположенной на контакте с вмещающей породой.
Мотивы и обстоятельства
Итак, кристаллы минералов возникают преимущественно в жидких и газообразных средах, в которых кристаллизующееся вещество находится в виде отдельных частиц - атомов, ионов, молекул. Частицы обладают большой кинетической энергией, совершая быстрые беспорядочные движения. Время от времени "нужные" частицы, случайно столкнувшись, сцепляются друг с другом, образуя зародыш - микроскопический клочок будущей структуры, всего несколько элементарных ячеек. Такой клочок уже мог бы самостоятельно расти, присоединять к себе новые частицы и со временем превратиться в настоящий кристалл, - если бы его не расшатывали собственные тепловые колебания, которые еще усиливаются бомбардировкой свободными частицами. Из-за этого зародыш рано или поздно распадается, и частицы разбегаются в разные стороны, возвращаясь в окружающую среду. Чтобы началась кристаллизация, надо дать зародышу хорошие шансы на выживание.
Для этого зародыш должен достигнуть достаточно большого размера: тогда силы связи между частицами воспрепятствуют его разрушению. Такая возможность появляется с понижением температуры расплава, с повышением концентрации раствора. В первом случае уменьшаются тепловые колебания, во втором - увеличивается вероятность встречи частиц друг с другом. Благодаря этому зародыш достигает той критической величины, при которой ему уже не грозит преждевременная гибель. Тогда он продолжает расти - идет кристаллизация.
| Минерал | Размер кристалла (в см) или его масса |
Место находки |
|---|---|---|
| Алмаз | 9; 605 г | Кимберли, ЮАР |
| Сера | 30 | Водинское, Поволжье, СССР |
| Пирит | 50 | Македония, Греция |
| Сфалерит | 15 | Забайкалье, СССР |
| Галенит | 25 | о. Мэн, Великобритания |
| Антимонит | 60 | о. Сикоку, Япония |
| Галит | 100 | Аллерталь, ФРГ |
| Флюорит | 200 | Нью-Мексико, США |
| Куприт | 4 | Тсумеб, Намибия |
| Хризоберилл | 10 | Урал, СССР |
| Анатаз | 4,5 | Бинненталь, Швейцария |
| Корунд | 61; 152 кг | Трансвааль, ЮАР |
| Гематит | 10 | о. Эльба, Италия |
| Кварц | 70 т | Казахстан, СССР |
| Кальцит | 600 | Эксифьорд, Исландия |
| Родохрозит | 12 | Колорадо, США |
| Церуссит | 60 | Тсумеб, Намибия |
| Азурит | 25 | Тсумеб, Намибия |
| Барит | 45 кг | Уэстморленд, Великобритания |
| Гипс | 800 | Чили |
| Вивианит | 150 | Анлуа, Камерун |
| Альмандин | 1 т | Суннфьорд, Норвегия |
| Уваровит | 2 | Оутокумпу, Финляндия |
| Аксинит | 22 | Баия, Бразилия |
| Данбурит | 30 | Дальнегорск, Приморье, СССР |
| Берилл | 1800; 380 т | о. Мадагаскар |
| Изумруд | 20 | Урал, СССР |
| Эпидот | 100 | Зеленцовская копь, Южный Урал, СССР |
| Микроклин | 1000 | Мосс, Норвегия |
Шансы на появление жизнеспособных зародышей значительно возрастают в присутствии затравок - посторонних зернышек, пылинок и пр. За счет поверхностных сил затравка собирает (адсорбирует) нужные частицы, сближает их и тем самым облегчает начало кристаллизации. В природной обстановке центры кристаллизации чаще всего возникают именно на затравках, которыми служат зерна вмещающей породы и особенно индивиды того же минерального вида.
Начавшаяся кристаллизация в конечном итоге приводит к образованию кристаллов более или менее значительной величины. Но рано или поздно изменение внешних условий прекращает кристаллизацию, а иногда даже вызывает растворение (расплавление) выросших кристаллов. Вслед за кристаллизацией данного минерала может начаться осаждение других. Их индивиды занимают оставшееся место и промежутки между ранними, уже выросшими кристаллами.
Наиболее крупные природные кристаллы принадлежат к редким находкам. Примеры таких кристаллов приводятся в таблице.
Итак, жизнь кристалла - природного или искусственного - начинается с зарождения и проходит различные этапы роста, а иногда и изменения. Образование кристалла - это самопроизвольный переход вещества из растворенного, расплавленного или газообразного состояния в состояние твердого тела с регулярным - кристаллическим - строением.
Почему происходит кристаллизация? Вопрос может показаться неожиданным только на первый взгляд: ведь должна же существовать какая-то причина, побуждающая сонм разрозненных, беспорядочно мечущихся частиц перегруппироваться в упорядоченный строй кристаллического тела!
На эту причину указывает очень важный физический принцип, утверждающий, что при определенных условиях (в которых обычно протекает кристаллизация) всякая совокупность (система) тел самопроизвольно стремится к состоянию с минимальной свободной энергией*. Свободная энергия - это та часть внутренней энергии системы, за счет которой может быть совершена работа, тогда как остальная энергия может перейти только в теплоту. Принцип минимизации свободной энергии надо понимать так: при отсутствии внешних воздействий всякое состояние неустойчиво, пока существует возможность перехода в другое состояние, в котором свободная энергия меньше. Лишь в состоянии с минимально возможной (в данных условиях) свободной энергией система приходит в равновесие - перестает испытывать тенденцию к изменениям. Камень "сам собой" скатывается с горы именно потому, что уменьшается свободная энергия (в данном случае потенциальная энергия в поле тяготения). Освободившаяся энергия расходуется на движение камня, работу против сил трения, работу расталкивания других камней и воздуха и их разогрев.
* (Принцип минимизации свободной энергии вытекает из фундаментального закона природы - второго начала термодинамики.)
Иллюстрацией принципа минимизации свободной энергии может служить и образование кристалла. Представим себе, например, пересыщенный раствор ионов натрия Na+ и хлора СL- - назовем это состоянием I. Как известно, из такого раствора могут выпадать кристаллы галита NaCl, причем кристаллизация идет до тех пор, пока концентрация раствора не снизится до уровня насыщения. Иначе говоря: если не предпринимать никаких действий, то система самопроизвольно приходит к состоянию II, когда она состоит из кристаллов и насыщенного раствора. Заняв фиксированные положения в кристаллической решетке и соединившись друг с другом, ионы теряют большую часть своей кинетической энергии и взаимно "гасят" энергию химических связей. С другой стороны, образование кристалла требует затраты энергии на перенос частиц в одно место и на образование поверхности кристалла. Но общий итог складывается все же в пользу кристаллизации: в состоянии II свободная энергия системы меньше, чем в состоянии I. Разница уходит на работу образования кристалла и частично рассеивается в виде тепла. Вместо кинетической энергии частиц, движущихся в растворе, остается лишь сравнительно небольшая энергия колебаний частиц в узлах решетки; нескомпенсированные связи сохраняются только на поверхности кристалла. Поверхность растет медленнее, чем масса и объем, а значит, доля поверхностной энергии по мере роста сокращается.
Таким образом, кристаллизация идет автоматически, самопроизвольно просто потому, что существует возможность уменьшения свободной энергии, и представляет собой в сущности один из способов ее уменьшения. Кристаллизация энергетически "выгодна": она приводит к отдаче энергии системой, и тем большей, чем крупнее кристалл. Кристаллизация может идти только при определенных условиях: в пересышенных растворах, переохлажденных расплавах.
Но при детальном рассмотрении дело обстоит несколько сложнее. Для полноты картины следовало бы преодолеть два логических затруднения. Первое связано с самопроизвольным зарождением кристалла. Пока зародыш еще не достиг критического размера, доля его поверхностной энергии столь велика, что на образование поверхности затрачивается больше энергии, чем освобождается за счет консолидации частиц. Возникновение зародыша и начальная фаза его роста приводят не к уменьшению, а к увеличению свободной энергии. Правда, по отношению ко всей системе увеличение ничтожно, но это не меняет дела: с точки зрения минимизации свободной энергии возникновение зародыша - парадокс. Принцип есть принцип.
В "оправдание" можно сказать, что принцип минимизации энергии лишь мотивирует поведение системы большого числа частиц и определяет генеральную тенденцию процесса, но не распространяется на поведение отдельных частиц в отдельные моменты времени. Что же, собственно, происходит с этими отдельными частицами? Беспорядочно двигаясь в жидкости или газе, они беспрерывно и случайным образом обмениваются энергией. В результате небольшая совокупность частиц на какой-то миг становится обладательницей энергии, достаточной для образования зародыша. К длительному самостоятельному существованию такой зародыш, может быть, и не способен, но присоединение следующих частиц доводит его до критического размера раньше, чем он распадается. Так в самом начале кристаллизации ей на помощь приходит случай.
По сути дела, все это закономерно. Всякий самопроизвольный процесс требует первоначального толчка, кратковременной затраты небольшой энергии. Камень не покатится вниз сам, пока его не подтолкнут; спичка не загорится сама, пока ею не чиркнут о коробок. Первоначальный толчок развязывает силы, уже готовые к действию. Для кристаллизации таким толчком служит возникновение зародыша.
В природных условиях, как уже отмечалось, зарождение кристаллов чаще всего облегчается наличием затравок.
Другое затруднение устранить сложнее, и касается оно самого для нас важного - формы кристалла. Стремясь к равновесному состоянию, растущий кристалл должен был бы "выбирать" себе и соответствующую равновесную форму, которая обеспечивала бы ему минимум свободной энергии. Такая форма во время роста сохранялась бы без изменений. Получается, что принцип минимизации свободной энергии предопределяет для каждого вещества раз и навсегда одну единственную кристаллическую форму.
Но дело как раз в том, что в действительности наблюдается вовсе не единственная форма. Принцип минимизации не может этого объяснить потому, что указывает лишь направленность, конечную цель процесса, не входя в его детали и длительность протекания. А между тем, система не просто испытывает тенденцию к минимизации свободной энергии, но стремится достигнуть минимума как можно скорее. И бывает так, что вторая тенденция - к максимальной скорости процесса - как бы наступает на пятки первой. Система чуть-чуть "ошибается", но такой ценой кристалл, приспосабливаясь к разнообразным обстоятельствам существования, реализует весь возможный темп роста. Как видим, процесс кристаллизации отчетливо носит диалектический, внутренне противоречивый характер. И именно этим в конечном счете обусловлено все разнообразие форм роста реальных кристаллов.
Как растет кристалл?
Каким образом извлекает он частицы из окружающего раствора, расплава, газа? Где и в каком порядке оседают частицы? Не имея возможности увидеть собственными глазами как все это происходит, ученые ждут ответа от теории роста кристаллов. Задача теоретика - раскрыть сущность явлений роста и предложить их количественное описание, своего рода прогноз. Далее за дело берется экспериментатор: он определяет опытным путем те или иные характеристики (скажем, скорость кристаллизации), сравнивает их с прогнозом теории и таким образом проверяет ее правильность. Если теория окажется верной, можно спросить ее и о том, что не удается узнать непосредственно из опыта.
Со времени первых попыток научного изучения кристаллов было предложено много теорий роста, но большинство их сейчас представляет только исторический интерес. Мы упомянем лишь о тех идеях, которые выдержали проверку временем и взяты учеными на вооружение.
Важнейшие энергетические закономерности, управляющие процессами зарождения и роста кристаллов, были установлены в конце прошлого века Дж. У. Гиббсом (1839-1903) - выдающимся американским физиком, одним из основоположников термодинамики. В 20-х годах нынешнего столетия немецкий физик М. Фольмер теоретически обосновал самопроизвольное зарождение и вычислил его вероятность. Он высказал также мысль, что на поверхности растущего кристалла возникает особый пограничный слой частиц, которые кристалл адсорбирует из питающего раствора, расплава или пара. Частицы "ползают" по поверхности кристалла, пока не найдут своего места на растущих гранях. Наличие адсорбционного слоя вносит в процесс кристаллизации определенные особенности.
В 1927 г. В. Коссель в Германии и И. Н. Странский в Болгарии занялись вопросом о том, в каком порядке частицы присоединяются к кристаллу. Благодаря идеально регулярному строению кристалл должен нарастать идеальными плоскими слоями - ритмично, слой за слоем. На рис. 15 показаны способы осаждения отдельной частицы (условно изображенной в виде кубика): 1 - на плоскость грани; 2 - в двугранный угол, образованный краем незаконченного слоя частиц; 3 - в трехгранный угол, образованный незаконченным крайним рядом частиц.
Последний способ предпочтителен, так как частица прочно связывается с кристаллом сразу тремя сторонами, что обеспечивает наибольшее сокращение свободной энергии. Поэтому достройка ряда получает энергетическое преимущество, и пока ряд достраивается, частицы оседают здесь гораздо чаще, чем в других местах растущей грани. Но вот ряд достроен до конца. Чтобы положить начало следующему ряду, частице приходится занять место в двугранном угле (см. рис. 15, 2), что несколько труднее, так как связь осуществляется только двумя сторонами кубика. Наибольшие же трудности возникают, когда наступает очередь следующего слоя, первая частица которого должна осесть на гладкую грань (см. рис. 15, 1). Связь с кристаллом настолько слаба, что эта одиночная частица вообще не в состоянии удержаться на грани, и сооружение слоя может начаться лишь после того как несколько частиц консолидируются в так называемый двумерный (однослойный) зародыш. Для этого требуется дождаться, пока волей случая на грани окажется одновременно нужное число частиц в близком соседстве друг с другом. Иначе говоря, при зарождении новых слоев возникают паузы, и они тем длиннее, чем ниже пересыщение. Паузы в основном и определяют скорость кристаллизации в целом.
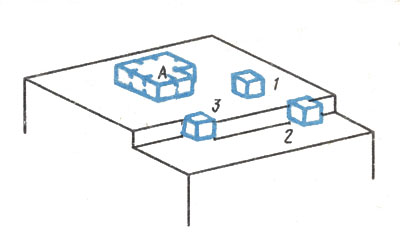
Рис. 15. Различные способы присоединения частицы к растущему кристаллу. А - двумерный зародыш
Теорию Косселя-Странского отличают последовательная логика и безукоризненные расчеты. И верховный судья всякой теории - эксперимент - подтверждает, что при достаточно высоких пересыщениях рост кристалла действительно идет в соответствии с теоретическим прогнозом. Но при низких пересыщениях кристаллы растут в сотни и тысячи раз быстрее, чем предсказывает теория. Они продолжают расти и при таких низких пересыщениях, при которых теория считает рост совсем невозможным. При малых пересыщениях кристаллы растут вопреки теории.
Физик всегда мечтает о такой теории, которая при всех обстоятельствах указывала бы правильную дорогу, объясняя явление с единой точки зрения. Но природа оставляет на это все меньше надежд. Она неизменно оказывается сложнее схемы.
Впрочем, не следует думать, что трудности послойного роста дискредитируют теорию Косселя-Странского в целом - ведь в большом диапазоне условий теория верна. Но с помощью одной лишь идеи послойного роста не удается представить целиком весь "механизм" кристаллизации. Очевидно, это идея должна быть чем-то дополнена.
Это хорошо понимал английский физик-теоретик Ф. Франк. Он предположил, что причина неудач теории Косселя-Странского заключена в ее исходном постулате об идеальной структуре кристалла. Рост идет беспрепятственно, пока на грани происходит достройка слоя и имеется ступенька, к которой легко пристраиваются частицы; слабое место теории - неизбежное исчезновение ступеньки и необходимость ее возобновления. В 1949 г. Франк высказал смелую мысль, что в действительности на грани имеется неисчезающая ступенька, навивающая на нее не плоские, а спиральные слои. Существование такой ступеньки Франк приписал нарушению регулярности строения реального кристалла, которое он назвал винтовой дислокацией. Идея Франка столь блестяще подтверждалась опытом, что физики принялись искать дислокации и вскоре получили неопровержимые доказательства их существования.
Винтовую дислокацию можно представить как частичный сдвиг в кристалле (рис. 16, А). Двугранный угол, который она образует на растущей грани, при встраивании новых частиц не исчезает, а лишь перемещается по винтовой поверхности, и кристалл наращивается непрерывным спиральным слоем - надобность в зарождении нового слоя отпадает. Прямая, вокруг которой закручивается спиральный слой, называется осью дислокации.
Минусы и плюсы дефектов
Получается, что своим существованием кристаллы обязаны собственным недостаткам - нарушениям, дефектам структур. Но как же растут "нормальные" кристаллы, в которых нет нарушений?
Парадоксальность ситуации дает повод поговорить о дефектах кристаллических структур вообще. Кроме винтовых, бывают краевые дислокации - дефект состоит в отсутствии части плоской сетки (рис. 16, Б). В кристаллах обычно имеются различные точечные дефекты: вакансии - пустые, незанятые узлы (рис.16, В) и атомы внедрения в междоузлия кристаллической решетки (рис. 16, Г); недостающие или лишние валентные электроны. Известны разного рода объемные и поверхностные дефекты.
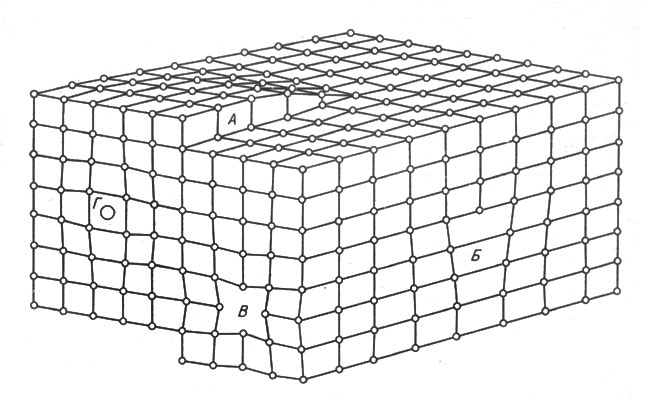
Рис. 16. Дефекты кристаллических структур: винтовая дислокация (А), краевая дислокация (Б), вакансия (В), внедрение атома в междоузлие (Г)
В обычном понимании "дефект" - это нечто случайное, отклонение от общего правила, от нормы. Так на первый взгляд обстоит и с дефектами структур. Энергетический минимум кристалла, а значит, его равновесность, стабильность обеспечиваются регулярностью строения. В дефектах же локализуется свободная энергия, а потому их существование кажется незаконным, ненужным кристаллу, случайной оплошностью в построении кристаллической структуры. А раз так, то тем или иным способом дефектов можно избежать.
Но оказывается, что такого способа нет. Загвоздка в самой малости: кристалл имеет температуру, т. е. обладает запасом тепловой энергии. Она раскачивает частицы, не давая им неподвижно покоиться в узлах решетки. Колеблясь, частицы и в кристалле продолжают обмениваться энергией. Время от времени какая-нибудь из них, получив достаточный энергетический импульс, выскакивает из узла, оставляет на своем месте вакансию и внедряется в междоузлие. С понижением температуры колебания уменьшаются, но полностью не исчезают. Допустим, нашелся бы способ гасить слишком сильные колебания, но это было бы возможно лишь ценой дополнительных (пусть косвенных) затрат энергии и еще дальше увело бы от энергетического минимума. Выходит, что дефекты неизбежны и, как это ни странно, даже нужны. Факт существования дефектов закономерен, хотя их положение в кристалле и численность более или менее случайны.
Поскольку точечные дефекты служат своего рода стоками энергетических излишков, их концентрация возрастает с температурой. При комнатных условиях кристаллы содержат по одной вакансии на каждые 1012-1014 атомов; при 350°С одна вакансия приходится уже на 105, а при 650°С - всего на каждую сотню атомов.
Дислокации возникают в скоплениях точечных дефектов, при неполном совпадении структур, когда в процессе быстрого роста кристалл присоединяет целый комплекс частиц, при неравномерном росте, механических напряжениях, тепловых деформациях и т. д. Реальный кристалл весь пронизан дислокациями: на каждом квадратном сантиметре сечения их насчитывается обычно десятки тысяч, а иногда и в миллионы раз больше. Но по сравнению с правильно расположенными атомами дефекты очень немногочисленны, и на форме кристаллов их присутствие обычно не отражается. От температуры количество дислокаций зависит мало.
По выражению видного советского кристаллографа Н. Н. Шефталя, "кристалл в первую очередь стремится расти, во вторую - расти наиболее совершенным". Бездефектная структура кристаллов - такая же идеализация, как и совершенно симметричная форма. Абсолютно "хороших" кристаллов попросту не бывает и, как мы убедились, принципиально не может быть.
Следовательно, структурные дефекты можно рассматривать наравне с другими свойствами реальных кристаллов. И только ли "дефектными" делают они кристалл?
Дефекты резко снижают прочность кристаллических тел. Избавившись от дислокаций, можно было бы за счет увеличения прочности многократно сократить расход материалов и массу конструкций, а это означало бы небывалые технические возможности и переворот во всех сферах деятельности человека, равного которому история еще не знала. Дефекты, особенно поры и микротрещины, заметно влияют и на химические свойства кристаллических тел, снижая их стойкость к коррозии. Скопления дефектов ухудшают пьезооптическое сырье, лазерные материалы и т. п.
Вместе с тем многими своими интересными и полезными качествами кристаллы обязаны именно структурным дефектам. Дефекты отлично "работают" в полупроводниках, придавая им широчайший спектр тех особых свойств, использование которых вызвало техническую революцию с далеко идущими экономическими и социальными последствиями. С дефектами связано такое важное качество минералов, как окраска: в половине случаев она обусловлена некоторыми точечными дефектами. Дефекты способны перемещаться: при температуре, близкой к точке плавления, скорость перемещения вакансий достигает нескольких метров в секунду. Правда, это движение хаотично и больше напоминает топтание на месте (за одну секунду вакансия смещается всего на несколько микрометроа), но все же оно делает принципиально возможной диффузию атомов, а, следовательно, перекристаллизацию в твердом состоянии.
Об огромном значении винтовых дислокаций для роста кристаллов читатель уже знает. Дефекты при определенных условиях могут оказывать влияние и на их внешний облик. Ведь и сам предмет нашего обсуждения - поверхность кристалла - не что иное как нарушение регулярности структуры, т. е. дефект.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'