
Глава 6. Основные стадии обмена веществ - метаболизма
Мы рассмотрим, конечно, не все пути обмена веществ в организме - это составляет содержание биохимии, а ограничимся некоторыми важнейшими отрезками путей, связанных с участием металлов.
В качестве примера проанализируем путь превращений глюкозы в организме - так называемый гликолиз.
Для удобства разделим весь процесс на отдельные стадии и представим его схематически (рис. 6). Глюкоза из пищи (или получившаяся из запасов гликогена в печени) прежде всего подвергается в клетках действию аденозинтрифосфорной кислоты (АТФ), которая переводит ее в глюкозо-6-фосфат. Эта реакция, как и последующие, катализируется специальными ферментами, о которых речь пойдет дальше. Пока отметим только химическую сторону превращений глюкозы.
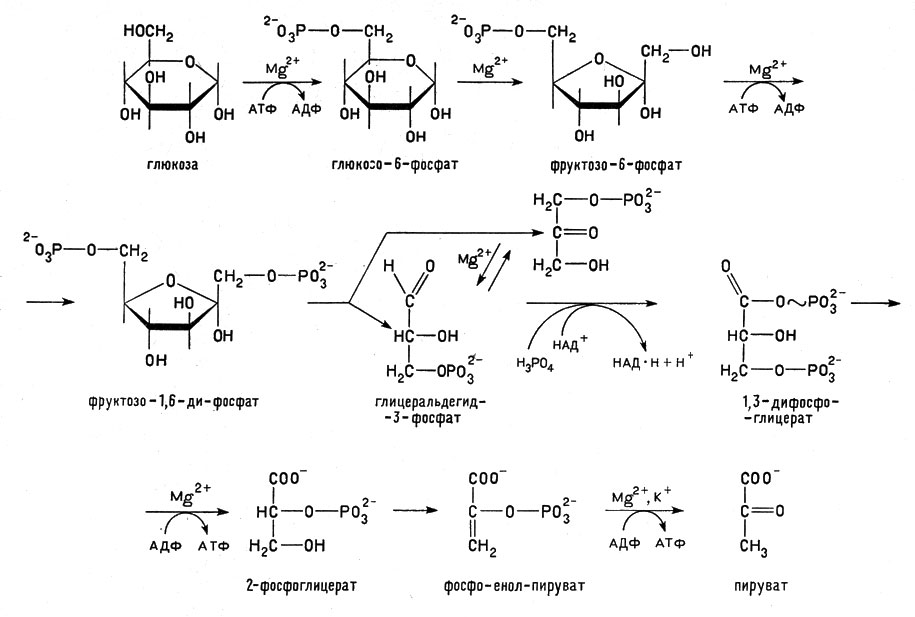
Рис. 6. Последовательные стадии гликолиза (брожения). Ионы магния, кальция и калия активируют ферменты гликолиза и ускоряют реакции
Полученный глюкозо-6-фосфат химически более активен, чем исходная глюкоза, - в этом, собственно, и заключается биохимический смысл фосфорилирования - превращения углевода в его фосфорильное производное. Затем происходит перегруппировка атомов, и получается уже не глюкозо-, а фруктозо-6-фосфат; далее следует вторичное фосфорилирование, и образуется фруктозо-1,6-дифосфат. Снова действует фермент (альдолаза), и цепочка из шести углеродных атомов фруктозодифосфата разрывается. Получается два трехуглеродных соединения: 3-фосфоглицеринальдегид и фосфодиоксиацетон. Эти родственные триозофосфаты могут взаимопревращаться. Фосфоглицеринальдегид подвергается действию фермента (дегидрогеназы) и кофермента - окислителя, сокращенное название которого НАД, а полное - никотин-амидадениндинуклеотид. НАД присоединяет к себе от окисляемого вещества (т. е. от фосфоглицеринальдегида) ион водорода, несущий отрицательный заряд, так называемый гидридный ион Н-. (Столь необычное состояние иона водорода характерно для гидридов некоторых металлов, например калия или натрия.) Молекула НАД действует в форме положительного иона НАД+ и переходит в нейтральное состояние. Второй ион водорода отщепляется от фосфоглицеринальдегида в виде Н+ и поступает в окружающую среду.
В реакцию вступает неорганический фосфат, и в результате образуется богатая энергией 1,3-дифосфоглицериновая кислота (ее соль - 1,3-дифосфоглицерат).
Отдавая один фосфорильный остаток АДФ и превращая ее в АТФ, эта кислота сама переходит в 3-, а затем 2-фосфоглицериновую кислоту. Последняя теряет воду (дегидратация) и превращается в фосфоенолпировиноградную кислоту и ее соль - фосфоенолпируват, которые восстанавливаются с помощью НАД*Н до молочной кислоты (точнее - лактата, так как получается не свободная кислота, а ее соль, имеющая такое название).
Несмотря на разнообразие стадий гликолиза, реакции совершаются согласованно во всех его частях благодаря действию специфических катализаторов - ферментов и ионов металлов, стимулирующих работу ферментативных механизмов. Ионы магния способствуют образованию фосфата глюкозы и дифосфата фруктозы. Ионы кальция и калия облегчают восстановление фруктозодифосфата до фосфоглицеринового альдегида. Ионы калия и магния облегчают образование пировиноградной кислоты. Образование АТФ из АДФ также ускоряется ионами магния.
На пирувате и лактате дело, однако, не кончается. Лактат является конечным продуктом лишь в отсутствие кислорода, в анаэробных условиях (например, в мышцах человека). При большой мышечной нагрузке он поступает с током крови в печень, где частично окисляется до диоксида углерода и большей частью до пирувата.
Клетка располагает еще одним замечательным аппаратом, который позволяет извлекать из углеводов гораздо больше энергии (сжигая их до конца - до СО2 и Н2О), чем это можно сделать с помощью только гликолиза. Этот аппарат - цикл Кребса, сопряженный с дыхательной цепью.
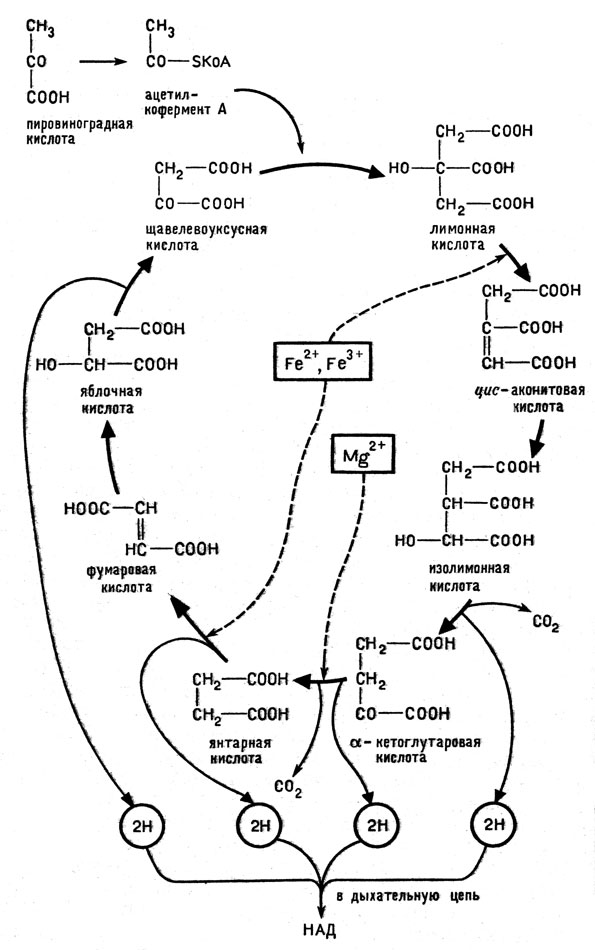
Рис. 7. Упрощенная схема цикла Кребса (цикла трикарбоновых кислот). Указаны ионы металлов, ускоряющие отдельные реакции цикла
Цикл Кребса называется так по имени ученого, открывшего его. Другое его название - цикл трикарбоновых кислот, которые играют здесь важную роль (рис. 7). В этот цикл вовлекается пировиноградная кислота, теряющая сначала водород и СO2; реакция имеет сложный характер и связана с участием системы ферментов. При этом от молекулы пировиноградной кислоты остается группа СН3СО - ацетил*. Ацетил реагирует со щавелевоуксусной кислотой (четырехуглеродной двухосновной карбоновой кислотой), образуя лимонную (шестиуглеродную трехосновную) кислоту. С этого, собственно, и начинается работа цикла. Затем следуют реакции образования цисаконитовой и изолимонной кислот, в молекулах которых имеется по шести атомов углеродов. Под влиянием фермента дегидрогеназы от изолимонной кислоты отщепляются два атома водорода, в результате чего она превращается в щавелевоянтарную кислоту (на схеме не показана), которая под действием декарбоксилазы отщепляет углекислый газ; при этом число атомов углерода в продукте реакции - кетоглутаровой кислоте - становится равным пяти. Кетоглутаровая кислота интересна тем, что в том месте, где она образуется, цикл пересекается с еще одним путем метаболизма. Так, при ее взаимодействии с аммиаком или ионами аммония образуется глутаминовая кислота, которая в дальнейших реакциях может превращаться и в другие аминокислоты; таким путем, в частности, в корневой системе растений аммиак вовлекается в синтез аминокислот.
* (Ацетил действует не в свободном состоянии, а в виде ацетил-кофермента А (АцКоА) - соединения его с коферментом А (КоА). Сам кофермент А состоит из аденин-нуклеотида, двух остатков фосфорной кислоты, пантотеновой кислоты (пант. к.) и аминоэтантиола:)
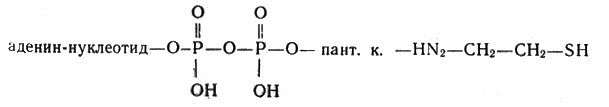
Кофермент А состоит из аденин-нуклеотида, двух остатков фосфорной кислоты, пантотеновой кислоты (пант. к.) и аминоэтантиола
Продолжим наше движение по циклу. Кетоглутаровая кислота превращается в янтарную (имеющую четыре атома углерода), теряя углекислый газ и два атома водорода; при этом одна молекула воды входит в цикл. Далее следуют реакции превращения янтарной кислоты в фумаровую, фумаровой - в яблочную и яблочной - в щавелевоуксусную. Как видно из рисунка 7, все эти превращения сопровождаются отщеплением двух пар атомов водорода и присоединением молекулы воды. Щавелевоуксусная кислота также может быть источником образования аминокислоты (аспарагиновой), однако ее основная функция заключается в том, что она в форме, содержащей двойную связь (енол), вступает в реакцию с остатком уксусной кислоты СН3СО (в составе ацетил-КоА), снова запуская цикл.
В работе цикла принимают участие ионы железа и магния, ускоряющие реакции, отмеченные на схеме стрелками. Так, активный центр фермента аконитазы содержит цистеин и ионы двухзарядного железа. Ионы железа в аконитазе осуществляют своеобразную функцию - они способствуют переносу группы ОН от одного атома углерода к другому, что необходимо для превращения лимонной кислоты в изолимонную. Ионы магния участвуют в работе фермента, который катализирует отнятие водорода от изолимонной кислоты. Скорость этой реакции определяет скорость прохождения всего цикла.
Подводя итог работы цикла за один оборот, мы видим, что молекула пировиноградной кислоты в результате прохождения цикла присоединила три молекулы воды, отдала в общей сложности пять пар атомов водорода и образовала три молекулы углекислого газа. Этот результат можно записать уравнением:
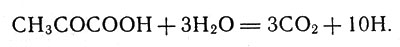
Молекула пировиноградной кислоты в результате прохождения цикла присоединила три молекулы воды, отдала в общей сложности пять пар атомов водорода и образовала три молекулы углекислого газа
Куда же девается водород, потерянный в этих реакциях? Он присоединяется к коферменту НАД+, а затем через флавиновые ферменты и цитохромы добирается до кислорода, образуя в конечном счете воду*.
* (Электроны, полученные при окислении пирувата до ацетила и углекислого газа, тоже попадают к НАД, но через переносчик ФАД.)
Обратим внимание на необычайную деликатность обращения химических машин клетки с тем сырьем, которое им приходится перерабатывать, и на то, как много сложных промежуточных этапов включает этот замечательный цикл, образующий водород и углекислоту и разделяющий их. Необходимо помнить, что каждый этап связан с определенным ферментом (всего в цикле участвуют восемь ферментов) и, следовательно, со специфическим белком, участвующим в катализе. Для чего все это? Неужели нельзя окислить уксусную кислоту менее хитроумным способом? Можно. Достаточно, например, насыпать в тигель перекиси натрия и добавить туда немного концентрированной уксусной кислоты, чтобы увидеть признаки бурной реакции: возникает пламя, выделяется теплота, и органическое соединение полностью сгорает до углекислого газа и воды. Однако энергия, полученная столь эффектным способом, теряется и, рассеиваясь в окружающей атмосфере, не может быть использована даже для простого нагревания.
Клетки используют энергию окисления для достижения многих разнообразных целей: механической работы мышцы, поддержания температуры тела и, самое главное, для осуществления химических синтезов, в частности синтеза белков. Вот почему окисление, при котором теплота просто рассеивается, неприемлемо для клеток. Здесь энергию надо сохранить и использовать не только на получение водорода, но и на его дальнейшее окисление таким образом, чтобы последнее было сопряжено с другой реакцией, поглощающей энергию, аккумулирующей ее, например, в форме связей в АТФ.
Водород после завершения цикла Кребса находится в форме НАД*Н, т.е. связан с коферментом фермента дегидрогеназы. Оказалось, что водород, отдаваемый НАД-Н, присоединяется затем к флавиновым ферментам (иначе называемым флавопротеидами, ФП), которые в свою очередь переходят в гидрированную форму, а кофермент НАД возвращается в прежнее состояние (НАД+) и готовится к приему новых частиц Н-. От флавиновых ферментов водород движется через дыхательную цепь, состоящую из белковых соединений железа - так называемых цитохромов, причем собственно по цепи цитохромов переходят электроны, а водород в виде ионов Н+ остается в водной среде.
Неожиданно выяснилось, что между циклом трикарбоновых кислот и дыхательной цепью существует еще одно звено. Его открыл Мортон в Англии, а затем Крейн и Грин установили характер его функций. Это соединение способно обратимо окисляться и восстанавливаться и представляет собой хинон с длинной боковой цепью: его назвали убихиноном ("вездесущий хинон"). Для хинонов характерна реакция восстановления: превращение кето-групп С=O в спиртовые группы С-ОН, сопровождающиеся перестройкой системы двойных связей, как это показано на схеме. Именно убихинон и передает электроны от флавиновых ферментов в цепочку цитохромов (сокращенно его обозначают KoQ):
Для хинонов характерна реакция восстановления
Подробнее мы опишем свойства цитохромов и работу дыхательной (или электронпереносящей) цепи в следующей главе.
От цитохромов электроны попадают к атомам кислорода. Получившиеся отрицательно заряженные ионы кислорода соединяются с ионами Н+, образуя воду - конечный продукт окисления.
Окислению в организме подвергаются, конечно, не только углеводы. По энергетической ценности на втором месте после углеводов стоят жиры. Подобный способ извлечения энергии применяется клетками и для окисления жиров в результате их превращения в ацетил-КоА.
Пути превращения белков в клетках сложны и многообразны. При гидролизе белков под влиянием протеолитических ферментов образуются аминокислоты. Последние могут дезаминироваться, иначе говоря, терять аминогруппу, или переаминироваться, т. е. обменивать группу NH2 на кетогруппу. Это дает возможность аминокислотам наряду с другими веществами принимать участие в цикле Кребса, в общем потоке жизненно важных реакций. Так, аминокислота - аспарагиновая (четыре атома углерода), теряя аминогруппу в процессе дезаминирования, превращается в щавелевоуксусную кислоту (четыре атома углерода), активно участвующую в цикле Кребса. Другой участник цикла - кетоглутаровая кислота (пять атомов углерода) - может появиться в результате превращений глутаминовой кислоты (пять атомов углерода), гистидина и др. Эти реакции перебрасывают мост между обменом белков и обменом углеводов и жиров. Цикл Кребса является, таким образом, универсальной биохимической машиной, перерабатывающей разнообразное сырье в углекислый газ и водород.
Сопоставляя особенности действия ферментов, участвующих в первых стадиях обработки пищевых веществ, с функциями последующих биохимических "блоков", нетрудно заметить, что наиболее специфичными по отношению к природе сырья являются начальные стадии. Углеводы подвергаются воздействию одних ферментных систем, жиры - других, а в результате из тех и других образуется ацетил-КоА. Очевидно, что коль скоро дело дошло до цикла Кребса, чувствительность к природе сырья снижается и проявляется только на перекрестках цикла и путей аминокислотного обмена. Еще менее специфично действие флавиновых и цитохромовых систем: откуда бы ни взялся водород, но если он попал к флавиновым дегидразам, они все равно отдадут его электроны в общий поток, текущий через систему переносчиков к кислороду.
Все рассмотренные выше процессы представляют собой реакции расщепления и последующего окисления. Энергия, выигранная при этом, накапливается в конечном счете в макроэргических связях аденозинтрифосфата (АТФ) или, более точно, в системе АТФ - вода (т. е. энергия, о которой идет речь, по величине равна энергии гидролиза АТФ).
Статьи расхода энергии в клетке и организме в целом весьма разнообразны. Энергия нужна для механической работы, связанной, например, с мышечной деятельностью, для поддержания надлежащего темпа выделения теплоты и, наконец, для многочисленных синтезов. Большое число молекул создается в живом организме, и притом так, что их образование требует затрат энергии. Затраты покрываются с помощью АТФ. Запас АТФ сам по себе невелик, но если организм располагает резервом в виде гликогена (углеводный биополимер), то в надлежащий момент гликоген переходит в глюкозу, затем глюкоза окисляется, и таким путем вновь возникает АТФ (см. гл. 8). Непосредственно к месту потребления энергия доставляется в форме макроэргических связей этого соединения.
Процессы, которые мы рассматривали до сих пор, состоят из последовательных реакций перестройки и синтеза молекул, причем источником энергии служат реакции, освобождающие скрытые запасы химической энергии. Так, энергия, заключенная в системе глюкоза - кислород, больше энергии системы углекислый газ - вода; первая система переходит во вторую в результате обмена веществ в организме. Именно благодаря разности в запасе энергии исходных и конечных веществ клетки осуществляют все операции, связанные с синтезом белков, мышечной деятельностью, поддержанием температуры на оптимальном уровне и другими процессами, идущими с затратой энергии.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'