
Глава 5. Активаторы и киназы
Мы переходим теперь к тем случаям участия металлов в действии ферментов, когда ион металла, не образуя прочных комплексов, тем не менее сильно повышает активность фермента, иначе говоря, играет роль активатора.
Ион металла, белок фермента и превращаемая молекула того или иного соединения (субстрат) в процессе реакции образуют различные промежуточные структуры. На рисунке 4 показаны возможные сочетания иона металла (М), субстрата и белка-фермента (Ф). Субстрат играет роль лиганда и обозначен L.
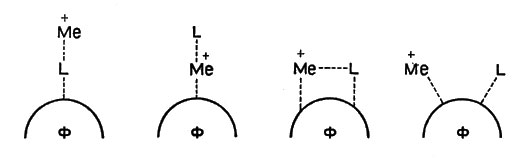
Рис. 4. Возможные сочетания белка (L), иона металла (М) и фермента (Ф)
Ион металла может действовать на лиганд, уже соединенный с белком, может располагаться между ними ("мостик"), может вступать в соединение с другой точкой белковой молекулы. При этом ион металла выполняет в общем случае сразу несколько функций: он поддерживает лиганд (субстрат) и белок в определенном пространственном положении, удобном для реакции, оказывает на связанные с ним молекулы или группы атомов поляризующее действие, смещая в них электроны, и, наконец, он может действовать как катализатор. Различить эти отдельные функции в общем эффекте повышения активности фермента очень трудно, и чаще всего механизм работы активаторов остается спорным.
Доказано, что ионы металлов делают более устойчивой ту форму белковой молекулы фермента (ее активной области), которая проявляет наибольшую каталитическую активность.
Важным ферментом, содержащим ион металла, а именно цинка, является карбоксипептидаза. Карбоксипептидаза вместе с другими ферментами, катализирующими гидролиз, разлагает молекулу пищевого белка на отдельные аминокислоты, из которых потом клетка построит нужные ей белки. Специальность карбоксипептидазы - отщепление аминокислотных остатков от того конца полипептидной цепочки белка, на котором находится карбоксильная группа, например:
Специальность карбоксипептидазы - отщепление аминокислотных остатков от того конца полипептидной цепочки белка, на котором находится карбоксильная группа
R обозначает какой-нибудь радикал, например СН3. Под влиянием карбоксипептидазы произошло отщепление концевой аминокислоты (в данном случае глицина); к концам разорванной связи присоединились ионы Н+ и ОН- молекул воды, как это вообще происходит при гидролизе пептидных связей NH-СО.
Молекулярная масса карбоксипептидазы 87000; молекула ее состоит из трех субъединиц и включает 307 аминокислотных остатков. Молекула имеет шаровидную форму, на ее поверхности недалеко от иона цинка обнаружены углубления и канал, по-видимому, содержащие молекулы воды и предназначенные для правильного размещения той части белковой цепочки, на которую действует фермент. Активный центр этого фермента построен довольно сложно и содержит большое число аминокислотных остатков, положение которых в настоящее время известно достаточно точно. Ион цинка связан с двумя остатками гистидина и глутаминовой кислоты (рис. 5).
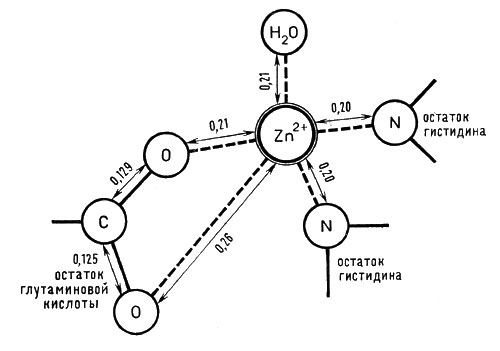
Рис. 5. Строение активного центра фермента карбоксипептидазы (расстояния между атомами даны в нанометрах)
Цинк удается заместить на ионы других металлов: кобальт(II), марганец(II), никель(II), причем получаются активные карбоксипептидазы. Относительная легкость такой замены и образование активных соединений с другими ионами - характерный признак многих случаев активации; здесь специфичность металла менее выражена, чем, например, в гемовых комплексах.
Все эти ионы способствуют связыванию субстрата (т. е. полипептидных белковых цепей) с активными центрами, кроме того, ион металла оттягивает на себя электроны кислорода карбонильной группы С=O (в пептидной связке СО-NH), в результате чего двойная связь между С и О поляризуется и облегчается ее реакция с водой, приводящая к разрыву С-N связи:
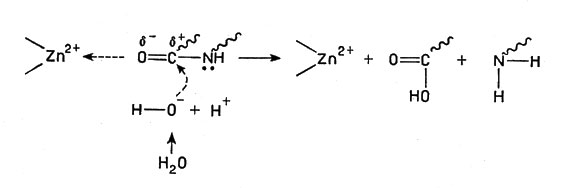
Ион металла оттягивает на себя электроны кислорода карбонильной группы С=O
(волнистая линия - полимерная молекула белка).
Ионы цинка, как мы уже упоминали, входят в состав еще одного фермента, функции которого тесно связаны с дыханием, - карбонангидразы. Этот фермент был выделен из эритроцитов человека и животных и оказался белковым соединением с молекулярной массой около 30000. На одну молекулу фермента приходится один атом цинка. В зависимости от источника получения молекулярная масса несколько колеблется, поэтому считают, что существует несколько видов карбонангидразы (изоферменты).
Карбонангидраза катализирует процессы гидратации диоксида углерода, т. е. образование иона НСО3-, и процессы дегидратации, связанные с выделением диоксида углерода вследствие разложения аниона угольной кислоты. Первый процесс совершается в клетках, отдающих СО2 как продукт своей жизнедеятельности, а второй - в альвеолах легких, где выделение СО2 должно происходить в надлежащем темпе.
Обе реакции можно записать так:
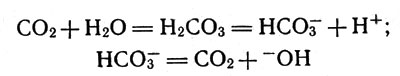
Карбонангидраза катализирует процессы гидратации диоксида углерода и процессы дегидратации
Первая представляет гидратацию СO2, вторая - разложение иона НСО3-.
Роль иона цинка еще не выяснена окончательно. Вероятно, ион цинка катализирует разложение НСО3- в результате образования комплекса, претерпевающего быстрый распад:
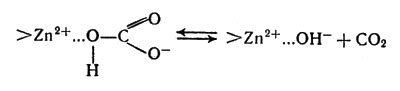
Ион цинка катализирует разложение НСО3- в результате образования комплекса, претерпевающего быстрый распад
Прямая реакция соответствует разложению бикарбонатов и протекает в легочных альвеолах, а обратная соответствует связыванию СO2 в клетках.
Ион цинка находится глубоко в центральной части белковой молекулы и связан с белком, насколько можно судить, с помощью трех гистидиновых остатков.
Киназы. Мы убедились, что для работы биологических машин необходимы переносы электронов и кислорода; дело, однако, этим не ограничивается. Ферменты клетки не перемешаны в беспорядке - важнейшие из них фиксированы в определенных зонах различных органелл (митохондрий, рибосом и др.), и перестройка молекул пищевых веществ, как уже упоминалось, идет строго согласованно и в нужной последовательности.
Для такой работы необходимо иметь средства, чтобы переносить и другие группы - особенно те, которые существенно изменяют запас энергии в молекуле и таким образом изменяют ее реакционную способность. Ферменты, катализирующие переносы фосфатной группы PO32- от молекулы аденозинтрифосфорной кислоты к другим молекулам, называются киназами (от греч. kineo - "двигаю, перемещаю").
Аденозинтрифосфорная кислота, сокращенно обозначенная АТФ, является одним из самых важных биологически активных соединений. Подвергаясь гидролизу, эта кислота отщепляет одну молекулу фосфорной кислоты (Ф), образуя аденозиндифосфорную кислоту (АДФ); при этом выделяется относительно много энергии. При образовании АТФ из АДФ и Ф энергия соответственно поглощается. Ниже приведено уравнение гидролиза АТФ* (и обратный процесс):
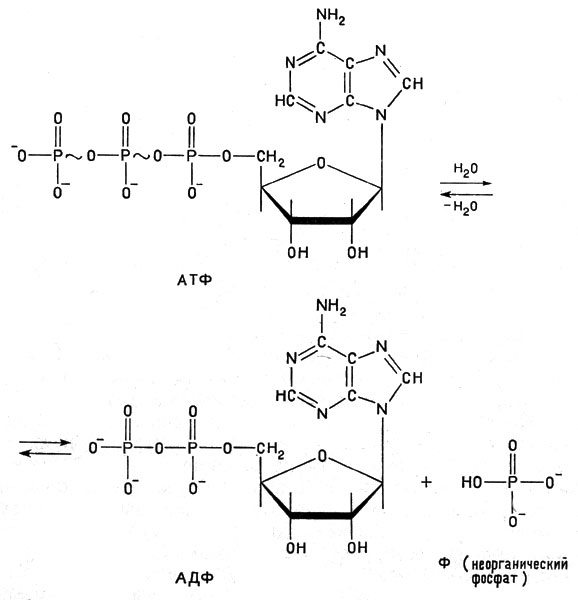
Уравнение гидролиза АТФ (и обратный процесс)
* (В формулах АТФ и креатинфосфата (см. ниже) волнистая линия обозначает химическую связь, богатую энергией, так называемую макроэргическую связь. Открытые концы вертикальных линий (связей) указывают положения атомов водорода.)
Если АТФ реагирует с какой-либо другой молекулой, например с молекулой глюкозы, то, передавая ей фосфатную группу, она передает молекуле и значительный запас энергии (заряжает молекулу глюкозы энергией):
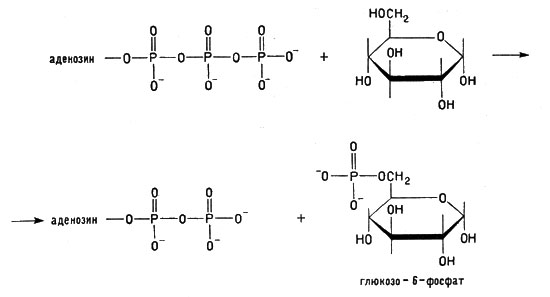
Реакция АТФ с молекулой глюкозы
Вот почему АТФ в клетках выполняет функции аккумулятора энергии.
Именно такого типа реакции, происходящие с переносом фосфата от АТФ на другой субстрат, и катализируются киназами. Киназы активируются ионами металлов, чаще всего магнием, а также кальцием и марганцем. Специфичность в этих случаях менее выражена, и указанные ионы можно иногда заменить на ионы кобальта или цинка. Но все ионы металлов, необходимые для работы киназ, двузарядны (степень окисления +2). Молекулярные массы киназ около 1000000, но неодинаковы у различных ферментов этой группы.
Ион металла, по-видимому, связывает АТФ и белок; доказано, что ионы металлов-активаторов образуют с АТФ комплексы. Способ связывания иона металла не всегда удается точно определить, хотя это важная сторона вопроса. Так, например, ион кальция активирует киназы, если он связан с белком-ферментом (Ф) через субстрат реакции:
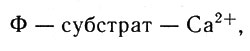
Ион кальция активирует киназы, если он связан с белком-ферментом (Ф) через субстрат реакции
но тормозит реакцию, если связан непосредственно с белком:
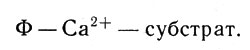
Ион кальция тормозит реакцию, если связан непосредственно с белком
Кроме того, ионы металлов, как активные частицы, способны вступать в реакции комплексообразования и с молекулами субстрата - того вещества, на которое переносится группа РО32-. По-видимому, основным этапом действия киназ является образование комплекса металл - АТФ, который, фиксируясь на белке, отдает фосфатный остаток субстрату.
В качестве субстратов особенно важны креатин и глюкоза (хотя изучены и другие реакции, например перенос РО32- на пируват, аргинин и др.).
Креатин, содержащийся главным образом в мышечной ткани, выполняет функции, аналогичные функциям АТФ. Он запасает энергию, образуя креатинфосфат; именно эта энергия и расходуется, например, при мышечной работе. Поэтому образование креатинфосфата
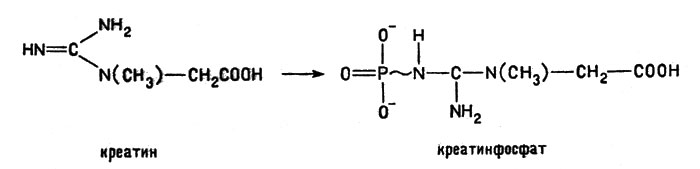
Образование креатинфосфата
представляет с точки зрения биохимика большой интерес. В реакции
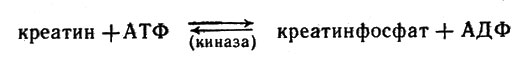
В реакции равновесие смещено влево
равновесие смещено влево.
Таким образом, ионы металлов (особенно магний) необходимы для нормального использования химической энергии фосфорных соединений, в частности для нормальной работы мышц.
Фермент, катализирующий образование креатинфосфата, называется креатинкиназой. Другой фермент - гексокиназа - катализирует перенос фосфорильной группы от АТФ к глюкозе:
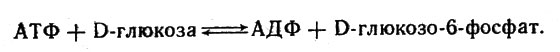
Гексокиназа катализирует перенос фосфорильной группы от АТФ к глюкозе
Фермент содержится в мышечной ткани, а также в мозге и дрожжевых клетках. Для его работы необходим ион магния. Вероятно, магний образует комплекс с АТФ: Mg*АТФ2-, присоединяющийся к белку-ферменту; ион магния, как полагают, с белком непосредственно не связан.
Характерной особенностью киназ является то, что их белковая часть испытывает определенные изменения формы при взаимодействии с субстратами. Фермент приспособляется к структуре той молекулы, на которую он действует.
Число различных ферментов, активизируемых теми или иными ионами металлов, очень велико. Ограничимся сведениями о киназах, но следует иметь в виду, что, изучая действие иона металла (не только двухзарядного!) на организм или клетку, всегда надо помнить о возможности активации ферментов этим ионом.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'