
5. Взаимодействие меди и ее сплавов с кислородом, водородом
Диаграмма состояния системы медь - кислород
Диаграмма состояния меди с кислородом [до 60% (ат.) O2] по обобщенным литературным данным [21, 22] приведена на рис. 35, f. В системе существуют следующие фазы: твердый раствор на основе меди - до 0,03% (ат.) O2 при 1066 °С, Cu2O при 33,3% (ат.) O2, Cu4О3 при 42,9% (ат.) O2. На рис. 35,6 показана диаграмма состояния этой системы в координатах lgpO2 - Т, где рO2- парциальное давление кислорода, Па; Т - температура, К. Эта диаграмма позволяет судить о стабильности различных фаз: твердого раствора на основе меди - Cu(c), Cu2O (с) - куприта,CuО(с) - тенорита. При нагреве на воздухе (lg pO2= - 0,67) CuО диссоциирует при 1031 °С с образованием Cu2O, которая плавится конгруэнтно при 1134 °С.
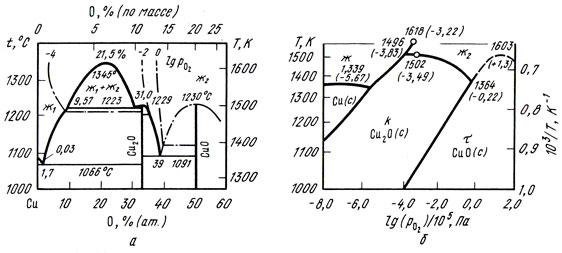
Рис. 35. Диаграмма состояния сплавов системы медь - кислород
Кислород в меди и медных сплавах
(Чурсин В. M. Плавка медных сплавов (Физико-химические и технологические основы). - М.: Металлургия. -1982. -152 с.)
Растворение кислорода в меди можно описать уравнением
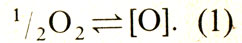
Константа равновесия реакции окисления
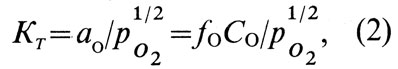
где aO, fO - активность и коэффициент активности кислорода в меди соответственно; СO - концентрация кислорода, % (ат.).
Коэффициент активности кислорода ƒ0O уменьшается с увеличением концентрации кислорода и понижением температуры расплава. В соответствии с полученными экспериментальными данными значения ƒ0O можно определить из следующего выражения:
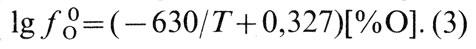
В сплавах меди активность кислорода отличается от его активности в чистой меди. Активность кислорода в медных сплавах зависит от сродства элементов или примесей к кислороду (рис. 36) [23]. Большинство элементов, входящих в состав медных сплавов, снижает активность кислорода в расплавах. В сплавах, содержащих элементы, обладающие высоким сродством к кислороду (Al, Si, Мn), активность кислорода очень мала [∼ 10-6% (ат.)]. Сплавы, содержащие элементы с меньшим сродством к кислороду (Zn, Fe, Sn, Со, Pb), имеют большее количество кислорода, и его активность составляет 10-2...10-5% (ат.). В реальных условиях ведения плавки [при содержании кислорода в меди менее 0,4% (по массе)] коэффициент активности кислорода, учитывающий отклонение системы Cu-О от закона Генри, может быть принят равным единице. В конечном виде активность кислорода в сплаве меди с каким-либо компонентом Хi описывается выражением:
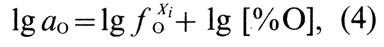
где ƒxiO - коэффициент активности кислорода, учитывающий влияние элемента; [%O] - концентрация кислорода, % (по массе).
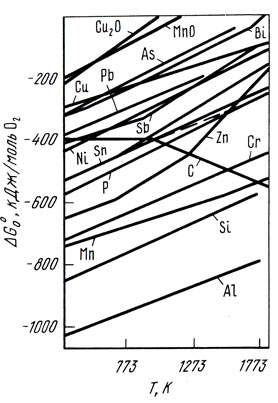
Рис. 36. Зависимость стандартных термодинамических потенциалов образования сплавов в меди от температуры
Для сравнительной оценки влияния различных элементов на активность кислорода в сплавах пользуются показателями параметров взаимодействия [О] и Xi при определенных температурах Т:
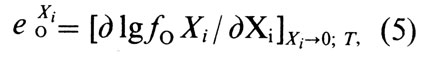
где еXiO, - параметр взаимодействия при концентрации [О], % (по массе).
Параметр взаимодействия и коэффициент активности (которые имеют одни и те же знаки) могут иметь положительные и отрицательные значения в зависимости от природы Xi. На основе формулы (5) коэффициент активности кислорода в бинарном сплаве меди с Хi можно определить по соотношению
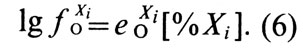
Это выражение тем точнее, чем ближе сплав к разбавленным растворам.
На рис. 37 приведены экспериментальные данные о влиянии некоторых элементов на активность кислорода в меди.
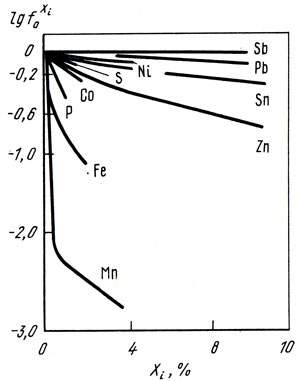
Рис. 37. Влияние элементов Хi на активность кислорода в меди при 1423 К
Данные в виде параметров взаимодействия и коэффициентов активности позволяют оценить влияние каждого компонента Xi на активность кислорода в бинарных сплавах Cu-Xi. В табл. 8 приведены активности кислорода аO в бронзах [23].
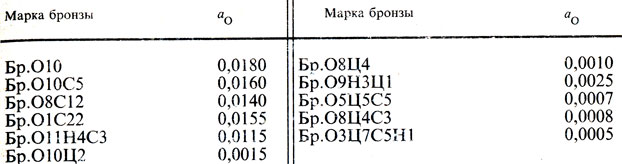
Таблица 8. Активность кислорода в бронзах при 1473 К
В бронзах, не содержащих цинка, активность кислорода относительно заметна (0,01...0,02), поэтому эти бронзы необходимо тщательно раскислять, а оловянно-цинковые бронзы содержат очень мало кислорода (aO = 0,001÷0,002), что свидетельствует о заметной раскислительной способности цинка в бронзах.
Раскисление сплавов меди
Экспериментальные значения активности кислорода в сплавах меди позволяют сделать количественную оценку раскислительной способности элементов по отношению к меди [23]. С увеличением содержания элементов Pb, Ni, Sn, Zn, Р, Mn, Cr, В, Fe, Co и других активность кислорода в меди линейно уменьшается. Выделяются сильные раскисляющие способности углерода, фосфора, железа, марганца, хрома, бора, бериллия в меди. К раскис-лителям меди предъявляются следующие требования.
1. Сродство к кислороду у раскислителя R должно быть, выше, чем у меди, т. е. ΔGRO >ΔGCu2O.
2. Раскислитель не должен отрицательно влиять на свойства меди, в первую очередь на его механические свойства.
3. Продукт раскисления (оксид RO или другое соединение) должен хорошо удаляться из металла.
4. Раскислитель должен быть дешевым, недефицитным, легко вводиться в расплав.
При плавке медных сплавов, используемых для ювелирного и художественного литья, фосфор - наиболее часто применяемый раскислитель [в виде фосфористой меди, содержащей 7...11% (по массе) Р]. Он хорошо растворяется в меди с образованием шлаковой фазы состава х Cu2O·у Р2О5.
Практика многолетней работы показывает целесообразность использования для раскисления небольших присадок фосфора (0,01...0,1%) почти для всех сплавов меди. Изменение вязкости и поверхностного натяжения оказывает благоприятное влияние на литейные свойства расплава.
Важность раскисления сплавов меди имеет практическое значение при последующей обработке отливок. В меди, раскисленной фосфором, окисный слой независимо от температуры его образования отслаивается легче. В то же время установлено, что ряд элементов (Be, Mg, Al) сильно замедляют окисление меди из-за образования барьерного защитного слоя, тормозящего диффузию кислорода внутрь металла [24]. Заметно замедляют окисление меди кадмий и кремний, а также цинк и олово, но в больших концентрациях. Все это необходимо учитывать при изготовлении отливок из сплавов меди.
Диаграмма состояния системы медь - водород
Экспериментально определены фазовый состав и растворимость водорода в меди [25]. На рис. 38 приведена диаграмма состояния системы медь - водород при давлении водорода 100 мПа. Растворимость водорода в меди зависит от температуры и давления и может быть рассчитана по уравнению
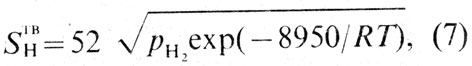
где STBH - растворимость водорода в твердой меди, см3/100 г;
pН2 - парциальное давление водорода, мПа; R - универсальная газовая постоянная, Дж/(моль·К); Т - температура, К.
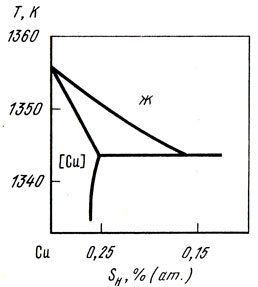
Рис. 38. Диаграмма состояния сплавов системы медь - водород при давлении водорода 100 мПа
Водород в меди и медных сплавах
Водород, растворяясь в меди и сплавах на основе меди, отрицательно влияет на их свойства. Растворимость водорода в жидкой меди в широком интервале температур носит экспоненциальный характер. Процесс растворения водорода в системах Cu-Xi можно выразить уравнением
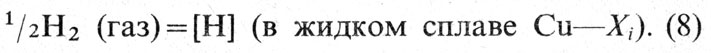
Константа равновесия процесса
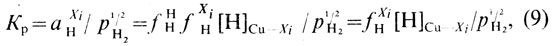
где ƒXiH - коэффициент активности водорода в сплаве Cu-Xi при постоянных (одинаковых) температурах и давлении; [Н]Cu-Xi.- растворимость водорода в сплаве Cu-Хi.
Коэффициент активности ƒXiH рассчитывают по уравнению
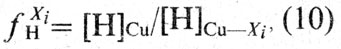
где [Н]Cu - растворимость водорода в чистой меди.
Растворимость водорода в многокомпонентных сплавах можно рассчитывать по формуле, предложенной К. Вагнером [26]:
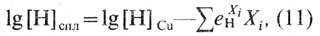
где [Н]СПЛ - растворимость водорода в сплавах, см3/100 г, при расчетной температуре и рН2 = 0,101 МПа; [Н]Cu- растворимость водорода в чистой меди, см3/100 г, при расчетной температуре и рН2 = 0,101 МПа; еXiH - параметры взаимодействия при расчетной температуре и pН2 = 0,101 МПа; Хi - содержание легирующих компонентов, % (по массе).
Равновесную расчетную растворимость при меньших, реальных парциальных давлениях можно определить по выражению Сивертса: [Н] = КН2(рH2)1/2, где KH2 = [Н]СПЛ при расчетной температуре и рН2 = 0,101 МПа; pH2 - реальное парциальное давление водорода в плавильной атмосфере.
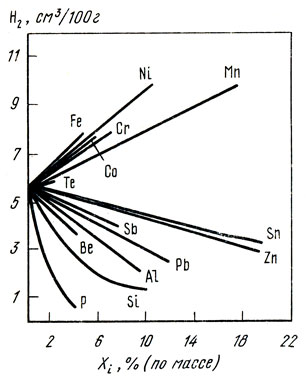
Рис. 39. Влияние элементов на растворимость водорода в жидкой меди при Т = 1423 К и рН2 = 0,101 МПа
Легирующие элементы в меди могут понижать, повышать или существенно не изменять величину растворимости кислорода в сплавах. Влияние элементов на растворимость водорода в жидкой меди показано на рис. 39 [23]. В системах медь - никель, медь - марганец, медь - железо с увеличением содержания легирующих элементов в сплаве растворимость водорода возрастает. В чистом марганце и никеле растворимость водорода значительно больше, чем в меди. В сплавах медь - никель [до 9% (по массе) Ni] и сплавах медь - марганец [до 18% (по массе) Mn] и в области давлений до 0,101 МПа соблюдается уравнение Сивертса. В сплавах медь - кремний, медь - олово, медь - цинк, медь - свинец растворимость водорода уменьшается. Исследованы следующие концентрационные интервалы, % (по массе): Si - до 10, олова - до 70, цинка - до 27, свинца - до 35. Свинец снижает растворимость водорода в меди особенно заметно в интервале концентраций 1...5%. Установлено также, что алюминий уменьшает растворимость водорода в сплавах с медью [23].
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'