
Раздел IV. Окислы (оксиды)
Общие замечания. Данный раздел обнимает простейшие соединения металлов и металлоидов с кислородом и гидроксилом. Кислородные соли мы будем рассматривать отдельно.
Кислород, как известно, в химических реакциях, совершающихся в земной коре, играет исключительную роль не только в неорганической, но и в органической минералогии. Кислородные соединения как в виде простых окислов, так и в виде разнообразных кислородных солей всюду в земной коре резко преобладают. Напомним, что среднее весовое содержание кислорода в земной коре составляет 49,13%.
В простейшие соединения с кислородом в том или ином виде входит около 40 элементов (рис. 141).
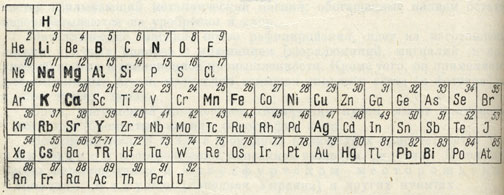
Рис. 141. Элементы, для которых характерны природные окислы и гидроокислы (набраны жирным и полужирным шрифтом)
Общее весовое количество свободных окислов в литосфере (за исключением гидросферы и атмосферы) составляет около 17%. Из них на долю одного только кремнезема приходится 12,6%. Окислы и гидроокислы железа составляют 3,9%. Из остальных наибольшее значение имеют окислы и гидроокислы алюминия, марганца, титана и хрома.
В атмосфере из окислов распространены углекислый газ и водяные пары, предел распространения которых находится на высоте 12 км от поверхности. В гидросфере, как показывает само название, главнейшей составной частью является вода.
Условия образования и химические особенности соединений. Основная масса разнообразных по составу окислов и гидроокислов сосредоточена в самых верхних частях земной коры-на границе ее с атмосферой, содержащей свободный кислород. Глубина проникновения свободного кислорода в земную кору контролируется в основном уровнем грунтовых вод. Кора выветривания горных пород вместе с зонами окисления рудных месторождений является главной ареной химических реакций, приводящих к новообразованиям, среди которых доминирующую роль играют окислы и гидроокислы металлов.
Весьма существенное значение при этом имеют не только свободный кислород воздуха, проникающий с поверхности в земную оболочку, но также дождевые просачивающиеся воды с растворенными в них кислородом и углекислым газом. Установлено, что в дождевой воде, насыщенной воздухом, на 1 л в среднем приходится 25-30 см3 газа, в составе которого около 30% кислорода, 60% азота и 10% углекислоты. Если мы сравним эти данные с составом воздуха, то увидим, что Дождевая вода значительно обогащена кислородом и, особенно, углекислотой. По мере того как эта дождевая вода спускается к уровню грунтовых вод, ее окисляющее действие постепенно ослабевает. Свободный кислород по пути просачивания дождевой воды расходуется на окислительные реакции. Особенно сильно этот расход проявляется при окислении сульфидов и им подобных соединений с образованием на первой стадии сернокислых, мышья-ковокислых и прочих солей.
Сравнительно легко подвергаются окислению также такие кислородные соединения, входящие в состав горных пород и руд, которые в своем составе содержат какие-либо металлы в низших степенях валентности, например Fe2+, Mn2+, V3+ и др. В процессе окисления эти металлы переходят в ионы высших валентностей, вследствие чего силы связей в кристаллических решетках ослабляются. Это в конце концов приводит к полному разрушению окисляющихся кристаллических веществ с образованием новых как растворимых, так и не растворимых в воде соединений.
Образующиеся первоначально при этих процессах соли (сульфаты, карбонаты и др.) с той или иной скоростью вступают в реакцию с водой, подвергаясь разложению или, как говорят, гидролизу, в результате чего ряд катионов металлов выпадает в виде трудно растворимых в воде гидроокислов.
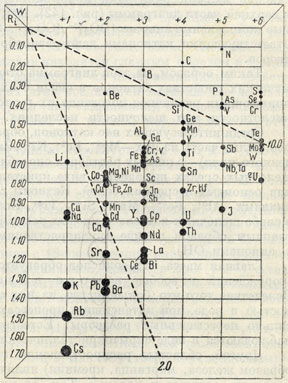
Рис. 142. Катионы, склонные к образованию гидроокислов (ограничены пунктирными линиями)
Известно, что поведение ионов в растворах находится в соответствии с ионными потенциалами, величины которых выражаются отношением заряда к ионному радиусу (W:Rj). Приведем список катионов, образующих труднорастворимые гидроокислы, в виде диаграммы (рис. 142), в которой катионы расположены в порядке увеличения валентности (вправо) и размеров радиусов ионов (вниз). Область катионов, склонных образовывать гидроокислы и окислы, на этой диаграмме очерчена с двух сторон пунктирными линиями.
Влево от этой области располагаются катионы сильных металлов с 8-элек-тронной конфигурацией во внешней оболочке, т. е. щелочей и отчасти щелочных земель (с ионными потенциалами меньше 2,0). Эти ионы, как мы знаем из химии, легко удерживаются и переносятся в водных растворах. В природных условиях они выпадают из растворов только в виде солей различных кислот. Исключение составляют лишь сильно поляризующие катионы с 18-электронной оболочкой (Cu1+ и Рb2+), встречающиеся в природе в виде окислов.
Катионы с очень высокими ионными потенциалами (больше 10), обладающие малыми радиусами ионов и большими зарядами, располагаются в верхней части диаграммы (рис. 142). Как известно, все они образуют прочные комплексные анионы: [ВO3]3-, [СO3]2-, [SO4]2-, [РO4]3- и др., которые с соответствующими катионами дают разнообразные соли, выпадающие из растворов.
Таким образом, на этой диаграмме отчетливо выступают различия в химических свойствах катионов в связи с их ионными потенциалами, обусловливающими различное поведение их в растворах в зависимости от степени кислотности или шелочности последних.
Среди интересующих нас катионов, образующих в природе окислы и гидроокислы, часть из них - Mg2+, Fe2+, Ni2+, Zn2+, Cu2+ и др. (в левой части очерченного поля)-в кислых растворах способна к легкому переносу, но в сильно щелочных средах выпадает в виде кристаллических осадков-гидроокислов или основных и средних солей. Катионы с более высокими ионными потенциалами-Al3+, Fe3+, Mn4+, Si4+ , Ti4+, Sn4+ и др.-уже легко осаждаются в слабо щелочных или слабо кислых растворах в результате гидролиза солей, главным образом в виде труднорастворимых гидроокислов (в соединении с анионами ОН).
Главная масса гидроокислов образуется в зонах окисления рудных месторождений и вообще в коре выветривания горных пород. Вследствие того что большинство из них обладает очень низкой растворимостью в воде, при интенсивных процессах окисления они способны давать сильно пересыщенные растворы. Естественно поэтому, что они обычно наблюдаются в виде скрытокристаллических и коллоидных масс.
Другой областью распространения гидроокислов металлов (главным образом железа, марганца, кремния) являются водные бассейны: болотные, озерные и морские. Так, во многих современных пресноводных озерах северных областей (Карелия, Финляндия, Швеция, Канада) в прибрежных мелководных участках наблюдаются скопления гидроокислов железа и марганца в виде рассеянных конкреций различных размеров и форм: шаровидных, эллипсоидальных, лепешковидных и неправильной формы масс. Наряду с гидроокислами Fe и Мп они почти всегда содержат гумусовые вещества.
Каким бы путем ни образовались гидроокислы, с течением времени, особенно в воздушно-сухой обстановке, они теряют капиллярную и адсорбированную воду с образованием соединений химически связанных гидроксильных групп и даже безводных окислов (Fe2O3, МNO2 и др.), особенно в областях с резко континентальным климатом. При процессах регионального метаморфизма, протекающих на умеренных глубинах, за счет гидроокислов происходит образование кристаллически-зернистых масс безводных окислов.
Если мы обратимся к вопросу о том, какие вообще элементы в виде безводных простых окислов образуются при эндогенных процессах минералообразования (магматических, пневматолитовых и гидротермальных), то увидим, что список их в точности отвечает списку тех же катионов, которые склонны при процессах гидролиза солей образовывать нерастворимые в водах гидроокислы (см. рис. 142). Таковы, например, кварц, рутил (ТiO2), касситерит (SNO2), корунд (Аl2O3), гематит (Fe2O3), браунит (Мn2O3) и многие другие. Двухвалентные катионы, примыкающие к этой главной группе катионов (рис. 142), гораздо реже встречаются в виде простых без водных окислов, но характерно, что они довольно часто наблюдаются в виде двойных окислов (минералы группы шпинели, так называемые титанаты, близкие к ним тантало-ниобаты и др.)- Если мы упомянем о газообразных окислах углерода и серы (СO2 и SO2), а также о воде (Н2O), то этим полностью исчерпаем весь список элементов, относящихся к рассматриваемому нами классу минералов.
Особенности кристаллического строения. Почти все относящиеся к данному разделу соединения обладают кристаллическими структурами, для которых характерна ионная связь структурных единиц.
В строении кристаллических решеток из анионов принимают участие: О2- (в окислах) и [ОН]1- (в гидроокислах). Размеры ионных радиусов того и другого примерно одинаковы: 1,32 и 1,33 Å соответственно. Следовательно все разнообразие структур кристаллов находится главным образом в зависимости от размеров катионов, их зарядов и их поляризационных свойств.
В кристаллических структурах этих соединений катионы всегда находятся в окружении анионов кислорода (или гидроксила), и координационные числа кристаллических решеток являются важной характеристикой этих минералов.
Сопоставляя между собой изученные структуры простых окислов, мы можем проследить различные варианты координационных чисел, начиная от довольно высококоординационных ионных решеток и кончая молекулярными, правда редкими, решетками, обладающими низкими числами и вандерваальсовской связью структурных единиц. Окислы двухвалентных металлов, характеризующиеся типичными ионными структурами, кристаллизуются в решетке типа NaCl, т. е. с координационными числами 6 и 6. Лишь окислы сильно поляризующих ионов с 18-электронной наружной оболочкой имеют структуры с более низкой координацией, например ZnO (4 и 4), а также Cu2O (4 и 2). Кристаллические структуры окислов трех- и четырехвалентных металлов, катионы которых имеют меньшие размеры, обладают более низкими координационными числами, падающими в соответствии с приближением ионной связи к гомополярной: А12O3( 6 и 4), UO2 (8 и 4), TiO2 (6 и 3), SiO2(4 и 2). В соединениях с молекулярными решетками эти числа еще ниже, например: для Sb2O3 (сенармонтит) - 3 и 2, для СO2 (твердой углекислоты) - 2 и 1.
Что касается сложных окислов, в составе которых участвуют катионы двух различных металлов, то координационные числа для каждого из них могут быть либо одинаковыми, либо различными. Например, для соединения FeTiO3 (ильменит) оба катиона - Fe2+ и Ti4+ находятся в шестерном окружении анионов кислорода, тогда как для соединений типа перовскита (СаТiO3) устанавливается другая картина: катионы Ti4+, Nb6+ и другие находятся в том же шестерном окружении, а катионы Са2+ и Na1+, обладающие большими ионными радиусами, имеют координационное число 12. В соединениях типа шпинели (MgAl2O4) по рентгенометрическим данным устанавливаются следующие координационные числа: для Mg2+ - 4, а для Аl+3 - 6.
Список катионов и их координационные числа в изученных кристаллических структурах простых и сложных окислов приводятся в табл. 6.
| Координационные числа | Катионы |
|---|---|
| 4 | Be2+,Mg2+,Fe2+,Mn2+,Ni2+,Zn2+,Cu2+,Si4+ |
| 6 | Mg2+,Fe2+,Mn2+,Al3+,Fe3+,Cr3+,Ti4+,Zr4+,Sn4+,Ta5+,Nb5+ |
| 8 | Zr4+,Th4+,U4+ |
| 12 | Ca2+,Na1+,Y3+,Ce3+,La3+ |
Гидроокислы, содержащие гидроксильные группы - [ОН]1-, например Mg[OH]2, а также окислы, содержащие в качестве катиона водород - Н1+, например НАlO2, по своему строению весьма существенно отличаются от типичных окислов. На сущности гидроксильной и водородной связей мы специально остановимся во введении к описанию гидроокислов. Здесь лишь укажем, что замена ионов 02- дипольными анионами [ОН]1- приводит к образованию типичных слоистых решеток с ионной связью в слоях и вандерваальсовской связью между слоями. При этом снижается симметрия кристаллической решетки. Например, MgO кристаллизуется в кубической решетке типа NaCl, тогда как Mg[ОН]2 - в гексагональной слоистой решетке. Точно также А12O3 кристаллизуется в тригональной сингонии, а Аl[ОН]3 - в моноклинной и т. д. Сильно поляризующие катионы типа купро не образуют самостоятельных гидратов, а лишь входят, как было уже упомянуто, в качестве компонентов в состав сложных солей, о которых речь будет итти в следующем разделе.
Все эти особенности кристаллических структур окислов сказываются и на физических свойствах минералов. Соединения, характеризующиеся ионной связью, обладают прочным кристаллическим строением, в целом несравненно более прочным, чем это наблюдается для галогенидов и сульфидов. В этом проявляется сильное химическое сродство к кислороду металлов, образующих подобные окислы. Прочность кристаллических построек выражается в высокой твердости этих окислов (6, 7, 8 и 9 по шкале Мооса), высокой химической стойкости, трудноплавкости, очень низкой растворимости и т. д.
Гидраты, обладающие слоистыми кристаллическими решетками, ввиду слабых связей между слоями характеризуются значительно менее прочными решетками. Замечательна их способность легко расщепляться по базальной спайности на тонкие листочки. Твердость гидратов двухвалентных металлов низкая; при замене их катионами трехвалентных металлов она увеличивается и особенно возрастает при наличии в решетках ионных групп [ОНО]3-(диаспор).
Окраска минералов также характеризуется своими особенностями. Соединения, в которых участвуют ионы типа благородных газов (Mg2+, Аl3+ и другие), как правило, бесцветны или имеют аллохроматическую окраску. Однако подавляющее число минералов, в которых роль катионов играют ионы несимметричного строения (Fe, Мn, Сr и др.), интенсивно окрашено в темные цвета. Особенно широко распространены черные окраски. Многие из этих минералов непрозрачны или просвечивают в тонких осколках и шлифах, причем по преимуществу обнаруживают бурые или красные оттенки. В соответствии с этим находятся и полуметаллические блески этих минералов. Явно повышены также и магнитные свойства минералов.
Классификация минералов. Все относящиеся к настоящему разделу минералы принято делить на:
- безводные окислы
- гидроокислы или окислы, содержащие гидроксил и водородные ионы.
Мы сохраним это деление, поскольку с кристаллохимической точки зрения оно является вполне оправдываемым.
В тех и других, кроме простых соединений, присутствуют двойные или более сложные соединения, выделявшиеся ранее в самостоятельные классы. К числу их принадлежат прежде всего двойные окислы типа RO-B2O3. Затем к ним относятся так называемые титанаты, ниобаты и танталаты. т. е. "соли" гипотетических кислот: титановой, ниобиевой и танталовой.
Как увидим ниже, рентгенометрические исследования всех этих соединений показали, что их кристаллические структуры не имеют ничего общего с типичными солями кислородных кислот. Наоборот, устанавливаются определенные их черты, тесно сближающие их с окислами.
Итак, в данном разделе мы будем рассматривать два класса соединений:
- I класс. Простые и сложные окислы.
- II класс. Гидроокислы или окислы, содержащие гидроксил.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'