
1. Группа галита
Сюда относятся хлориды одновалентных металлов Na и К. Здесь же опишем водный двойной хлорид К и Mg.
Галит - NaCl. "Галос" по-гречески - море, соль. Синонимы: каменная соль (в плотных крупнокристаллических массах, залегающих среди горных пород) и самосадочная соль (в рыхлых кристаллических агрегатах на дне соленосных бассейнов).
Химический состав. Na 39,4%, С1 60,6%. Примеси большей частью механические: капельки рассола, пузырьки газов, включения глинистого или органического вещества, гипса, КС1, MgCl2 и др.
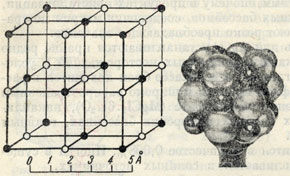
Рис. 138. Кристаллическая структура NaCl. Справа - модель структуры. Черные кружки - ионы натрия, белые - ионы хлора (или наоборот)
Сингония кубическая; гексаоктаэдрический в. с. 3L44L636L29PC. Кристаллическая структура характеризуется типичной ионной связью. Она изображена на рис. 138. Как можно видеть, в основе ее лежат решетки двух гранецентрированных кубов, как бы вставленных друг в друга. Ионы Na1+ и Сl1-располагаются поочередно в углах малых кубов. Координационные числа для обоих ионов равны 6, т. е. каждый отрицательный ион хлора окружен шестью положительно заряженными ионами натрия, и наоборот. Таким образом, заряд каждого иона в электростатическом поле компенсируется полностью окружающими его противоположно заряженными ионами.
Облик кристаллов, как правило, кубический. Грани {111) и {110} встречаются очень редко (при кристаллизации из сложных по составу растворов). Двойники редки по (111). Для кристаллов самосадочной соли бывают характерны воронкообразные ступенчатые углубления на гранях (100).
Агрегаты. Самосадочная соль наблюдается в виде рыхлых или плотных кристаллически-зернистых корок или "пластин" на дне бассейнов, а также друз кристаллов, нередко очень крупных.
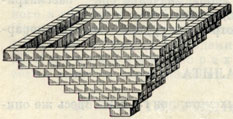
Рис. 139. Кристаллическая 'лодочка' NaCl
Интересно отметить, что при быстром испарении растворителя - Н2O на самой поверхности рассолов в тихую погоду возникают многочисленные плавающие кристаллические "лодочки" (рис. 139), разрастающиеся в основании, обращенном кверху. Они имеют белый цвет, очевидно вследствие захвата микроскопических пузырьков воздуха. При волнении они заполняются водой, оседают на дно и продолжают свой рост, образуя уже нормальные прозрачные кристаллы. Однако нередко в них сохраняются внутренние елочковидные или конвертовидные участки молочно-белого цвета.
Каменная соль, возникающая в результате собирательной кристаллизации в процессе метаморфизма, образует необычайно крупнокристаллические массы, о чем можно судить по размерам спайных плоскостей. Характерно, что при перекристаллизации образуются часто совершенно прозрачные массы галита (очевидно, включения жидкостей и газов при этом "отгоняются" к периферии кристаллических зерен).
Цвет. Чистые массы галита прозрачны и бесцветны или имеют белый цвет. Но часто те или иные красящие пигменты обусловливают окраску в различные цвета: серый (обычно глинистые частицы), желтый (гидроокислы железа), красный (безводная или маловодная окись железа), бурый и черный (органические вещества, исчезающие при нагревании) и др. Для каменной соли иногда наблюдается очень характерная интенсивная синяя окраска в виде пятен или полос, особенно в участках, подвергшихся сильной деформации. Искусственно такая окраска получается при облучении каменной соли рентгеновскими лучами или при пропитывании ее парами металлического натрия, особенно если образец предварительно подвергнуть одностороннему сжатию. При нагревании до 200° окраска исчезает, и соль становится бесцветной. Предполагают, что окраска возникает вследствие того, что ионы Na1+ приобретают свободные электроны (β-частицы радиоактивных лучей) и потому становятся электрически нейтральными атомами. Тот факт, что синяя соль встречается в тех участках, где присутствуют калийсодержащие хлориды, позволяет считать вероятным, что К и обычно связанный с ним Rb, способные в какой-то степени излучать β-частицы (электроны), действительно могли обусловить эту окраску.
Блеск галита стеклянный, на поверхностях слегка выветрелых разностей жирный. N = 1,544 (существенно выше, чем у сильвина). Твердость 2. Хрупок. При продолжительном одностороннем давлении обнаруживает способность к пластической деформации. Спайность весьма совершенная по кубу (см. рис. 23), что вполне согласуется с особенностями кристаллической структуры минерала. Уд. вес 2,1-2,2. Прочие свойства. Обладает слабой электропроводностью, исключительно высокой теплопроводностью. Легко растворим в воде: до 35% при комнатной температуре (при повышении температуры на первые десятки градусов растворимость мало меняется). Вкус соленый. Гигроскопичен, но в значительно меньшей степени, чем хлориды калия и магния.
Диагностические признаки. Легко узнается по низкой твердости, весьма совершенной спайности, растворимости в воде и соленому вкусу раствора.
П. п. тр. на угле легко плавится (800°), обычно растрескиваясь и окрашивая пламя в желтоватый цвет. Из раствора, подкисленного азотной кислотой, AgNO3 выделяет белый творожистый осадок AgCl.
Происхождение. Главные массы галита, как и других растворимых в воде солей, образуются при экзогенных процессах в усыхающих замкнутых соленых озерах или мелководных лагунах и заливах, отделенных от морского бассейна песчаными баРbерами (баррами), в условиях жаркого сухого климата. В летнее время в таких мелководных заливах, при прогреве воды и большой поверхности испарения, концентрация растворенных солей все время увеличивается по сравнению с морским бассейном. Происходящее при этом понижение уровня обусловливает беспрерывный приток свежей морской воды, а следовательно, и добавочного количества растворенных солей. С наступлением осеннего похолодания из насыщенных растворов выпадают те или иные соли, в зависимости от концентрации компонентов. Если данный бассейн не сообщается с морем и не вбирает в себя пресных текучих вод, то в момент наступления насыщения при испарении происходит садка соли и в летнее время.
Состав воды в различных материковых соленых озерах весьма разнообразен. Он зависит, с одной стороны, от состава питающих озеро вод, т. е. от состава окружающих горных пород, а с другой - от стадии усыхания озера и связанной с ней относительной концентрацией остающихся в рассоле компонентов. Во многих таких озерах наряду с другими солями осаждается также NaCl.
В ископаемых соленосных осадках, образовавшихся в прошлые геологические эпохи, галит встречается в виде сплошных масс каменной соли. Соляные залежи, располагаясь среди осадочных пород, во время горообразовательных движений, в силу большой способности к пластическим деформациям, легко меняют свою форму, образуя часто мощные, сложные по форме и строению купола, иногда прорывающие вышележащие осадочные породы. При этом тонкослоистые отложения солей претерпевают часто очень сложные микроскладчатые деформации.
В пустынях, как известно, широко развиты так называемые солончаки, представляющие собой выцветы солей, в составе которых почти постоянно принимает участие NaCl. Они после дождей исчезают и вновь появляются в сухую погоду.
Наконец, в виде продуктов возгона галит вместе с другими хлоридами отлагается на стенках кратеров вулканов и в трещинах лавовых потоков. Размеры подобных скоплений, за крайне редкими исключениями, обычно бывают невелики. Характерно, что галит в этих случаях почти всегда содержит в себе довольно много КСl, который при высоких температурах, как установлено экспериментом, входит в него в виде твердого раствора.
Практическое значение. Применение галита весьма разнообразно. Помимо того что он является важнейшим пищевым продуктом и консервирующим средством, он широко используется в химической промышленности для получения соляной кислоты, хлора, соды, едкого натра и ряда солей. Кроме того, галит является исходным сырьем для получения металлического натрия, который применяется: для изготовления антифрикционных сплавов (натриево-кальциевых баббитов); для получения перекиси натрия, используемой в текстильной промышленности при отбеливании тканей; в качестве каталитического агента при производстве сложных органических соединений; в черной и цветной металлургии как восстановитель и для удаления серы; как поглотитель влаги и кислорода при очистке благородных газов (гелия, неона, аргона и др.); в электротехнике при изготовлении разрядных ламп с парами натрия, имеющих большую силу света, а также при изготовлении электропроводов, состоящих из натриевых "жил", покрытых оболочкой меди, и др
Месторождения. Наиболее крупные запасы галита сосредоточены в месторождениях каменной соли. Они образовались в различные геологические эпохи, но наиболее значительные месторождения приурочены к осадкам пермского периода, характеризовавшегося продолжительным континентальным жарким климатом (на территориях Европы, Южной Азии, Америки и др.).
Из месторождений СССР отметим наиболее важные: Славянскo-Артемовское (Бахмутское) месторождение (Украина), представленное 18 пластами каменной соли, переслаивающимися с глинами, ангидритами и известняками; Илецкая Защита (к югу от г. Чкалова), где мощный шток каменной соли был прикрыт лишь небольшими наносами, а пласты каменной соли вместе с ангидритами сильно перемяты; Соликамское (Верхнекамское) - крупнейшее в мире месторождение калийных и магниевых солей, в котором залегают также мощные толщи каменной соли и гипса, и др.
Из современных месторождений самосадочной соли заслуживает внимания известное оз. Баскунчак (к востоку от пристани Владимирской в низовьях р. Волги). Впадина озера располагается у северного склона погребенного под толщей гипсов соляного купола. Отложения кристаллической соли сверху покрыты рапой (рассолом).
Из иностранных месторождений упомянем лишь некоторые. К числу давно известных месторождений каменной соли принадлежит месторождение Величка к юго-востоку от г. Кракова (Польша), разрабатывающееся еще с XI в.; огромный шток каменной соли расположен у г. Суэца; очень крупные залежи каменной соли известны в Северной Индии, вдоль Гималайских гор в Пенджабе и др
Сильвин - КСl.
Химический состав. К 52,5%, С1 47,5%. Часто содержит включения жидкостей и газов, главным образом азота, в меньшей степени углекислоты, водорода, метана и, что особенно интересно, гелия. Из механических примесей часто устанавливаются NaCl и Fe2O3. В виде изоморфной примеси почти постоянно присутствуют КВr (до 0,1%) и в ничтожных количествах RbCl к CsCl.
Сингония ромбическая; гексаоктаэдрический в. с. 3L44L636L29PC. Кристаллическая структура такая же, как у галита: гранецентрированный куб (см. рис. 138). Величина элементарной ячейки существенно больше, чем у галита. Облик кристаллов кубический. Нередко наблюдаются кубы, притуплённые по углам гранями октаэдра. Двойники часты по {111}. Агрегаты. Обычно встречается в виде сплошных зернистых масс, иногда слоистой текстуры.
Цвет. Чистые разности водяно-прозрачны и бесцветны. Молочно-белый цвет обусловлен включениями мельчайших пузырьков газов. Яркокрасные и розовые сильвины также являются кристаллозолями; в виде грубой дисперсной фазы в них заключены мельчайшие чешуйки гематита (Fe2O3), остающиеся в осадке при растворении. Блеск стеклянный. N = 1,490 (меньше, чем у галита).
Твердость 1,5-2. Хрупок. При продолжительном одностороннем давлении обнаруживает свойство пластичности. Спайность весьма совершенная по {100}. Уд. вес 1,97-1,99. Прочие свойства. Вкус горьковато-соленый, жгучий. Теплопроводность высокая. Легко растворяется в воде. Гигроскопичен. Прозрачные разности хорошо пропускают коротковолновые лучи, на чем основано применение его для призм спектроскопа.
Диагностические признаки. Похож на галит, с которым часто образует зернистые срастания. Отличается от него по вкусу и окрашиванию пламени в фиолетовый цвет, видимый через синее отекло. Под микроскопом от галита отличается по показателю преломления.
П. п. тр. легко плавится (800°). Раствор, подкисленный азотной кислотой, с AgNO3 дает творожистый белый осадок AgCl.
Происхождение. Сильвин, так же как и галит, образуется в усыхающих соляных озерах, но встречается по сравнению с ним гораздо реже - далеко не во всех месторождениях каменной соли. По пути миграции поверхностных растворов в значительной части адсорбируется почвами. Из рассолов он выпадает одним из последних и потому обычно встречается в верхах соленосных скоплений.
Иногда он является продуктом разложения карналлита, образующегося в тех же условиях.
Как продукт сублимации он встречается на стенках кратеров вулканов и в трещинах застывших лав.
Практическое значение. В подавляющей своей массе калийные соли идут на удобрения полей. Лишь очень незначительная часть их (около 5%) используется в химической промышленности для приготовления КОН, К2СO3, KNO3, КСlO3, KMNO4, KCN, КВr, КJ и других соединений. Эти соединения имеют различное применение: в медицине, парфюмерии, пиротехнике, фотографии, для очистки шерсти, в бумажном, стекольном (при изготовлении хрустального и бемского стекла), лако-красочном и других производствах.
Месторождения. Величайшее в мире Соликамское месторождение сильвина находится в 35 км к северу от г. Молотова. Оно открыто в 1925 г. Мощный нижний горизонт сильвинита (галит-сильвиновой породы) залегает на глубине 150-300 м на толще каменной соли и покрывается зоной карналлита в смеси с галитом. Содержание КСl в сильвините колеблется от 10 до 35%. Верхний сильвинитовый горизонт является продуктом разложения карналлитовой зоны (с выносом MgCl2) и представлен грубозернистой пестро-цветной массой, в которой сильвин молочно-белого цвета ассоциирует с бесцветной, голубой, синей и сероватой каменной солью.
До открытия Соликамского большой известностью пользовались Стассфуртские и другие месторождения Западной и Северной Германии. Соляные залежи здесь того же пермского возраста и имеют довольно сложный состав галоидных, сернокислых и борных соединений. Сравнительно молодого-третичного возраста сильвиниты разрабатываются в Эльзасе (Франция).
Карналлит - MgCl•КСl•6Н2O. Химический состав. Mg 8,7%, К 14,1%, Сl 38,3%, Н2O 38,9%. В очень небольших количествах устанавливаются изоморфные примеси Вr (до 0,2%), а также Rb и Cs (в сотых долях процента), изредка Li и Тl. Из механических примесей обычно присутствуют NaCl, КСl, CaSO4, Fe2O3, глинистое вещество, капельки рассолов, часто обильные включения газов (смесь азота с водородом и метаном).
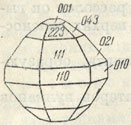
Рис. 140. Кристалл карналлита
Сингония ромбическая; ромбо-дипирамидальный в. с. Кристаллы крайне редки; имеют псевдогексагональный облик (рис. 140). Обычно встречается в сплошных зернистых массах.
Цвет. Чистые разности бесцветны. Обычно окрашен в розовый или красный цвет включениями тонко распыленной окиси железа. Бурый или желтый цвет обусловлен примесью гидроокислов железа. Блеск в свежем изломе стеклянный, на воздухе быстро тускнеет и становится жирным. Ng = 1,494, Nm = 1,475 и Np = 1,466.
Твердость 2-3. Хрупок. Спайность отсутствует. Уд. вес 1,60. Прочие свойства. Необычайно гигроскопичен. Легко расплывается ,на воздухе, причем разлагается на КСl и MgCl2•6H2O, образуя густой рассол. Вкус жгучий, горько-соленый. Сильно флюоресцирует. При растворении в воде издает особый треск, похожий на хруст снега под ногами в сильный мороз. Это явление обусловлено тем, что в нем чаще, чем в других солях, присутствуют включения пузырьков газов, находящихся под большим давлением.
Диагностические признаки. Встречается в парагенезисе с каменной солью и сильвином. На воздухе быстро сыреет. От бишофита и тахгидрита, также расплывающихся на воздухе, отличим лишь по микрохимическим реакциям (содержит К) и по окрашиванию пламени в фиолетовый цвет, лучше заметный через синее стекло. При сверлении острием ножа в свежем изломе издает характерный треск, обусловленный внезапным расширением включенных пузырьков газа.
П. п. тр. легко плавится. При нагревании на стекле зерна карналлита, как и многие другие богатые водой кристаллогидраты, растворяются в собственной кристаллизационной воде и разлагаются. При постепенном высушивании образуются мелкие кубики КС1.
Происхождение. Образуется одним из последних из рапы соляных озер, обогащенной магнием и калием. Поэтому встречается в верхних горизонтах погребенных соляных залежей осадочного происхождения, образуя горизонты выше отложений сильвинита. Иногда выделяется на стенках сухих выработок из стекающих по поверхности полости рассолов.
Практическое значение. Так же как сильвин и другие соли калия, служит сырьем для удобрений почв.
При электролизе обезвоженного карналлита в закрытых ваннах получается всплывающий металлический магний; обогащенные калием остатки перерабатываются на удобрения и хлор.
Металлический магний, после рафинирования, идет на изготовление легких прочных сплавов с алюминием (дюралюминий, магналий и др.), употребляемых в авиационной промышленности. Кроме того, он применяется для сигнальных огней, получения вспышек сильного света (в фотографии) и для других целей.
Бром, получаемый из рассолов химическим путем, имеет применение в медицине (бромистый калий), фотографии и пр.
Месторождения. В СССР в громадных количествах присутствует в Соликамском месторождении, описанном выше (см. Сильвин). В больших массах известен также в Стассфуртском месторождении (Германия), Калуше (Западная Украина) и других пунктах.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'