
Раздел I. Самородные элементы и интерметаллические соединения
Общие замечания. В самородном состоянии в земной коре устанавливается свыше 30 химических элементов, главным образом металлов. Сюда же относятся ряд газов и редко встречающиеся элементы в жидком состоянии (ртуть, некоторые амальгамы).
Общее весовое значение самородных элементов в земной коре очень невелико (не превышает 0,1% всей массы земной коры). Из этого количества на долю азота приходится около 0,04%, кислорода - 0,01-0,02%.. Все остальные элементы, встречающиеся в самородном виде, составляют, следовательно, не больше 0,05%. Из них в наибольших относительных количествах представлены: водород, аргон, гелий, углерод, сера, золото, элементы платиновой группы, медь и висмут.
Некоторые химические элементы в природе встречаются исключительна или почти исключительно в самородном состоянии и носят название благородных элементов. В приводимой таблице (рис. 61) они набраны жирным шрифтом.
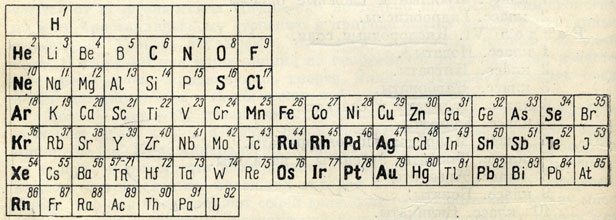
Рис. 61. Элементы, встречающиеся в самородном виде (набраны жирным и полужирным шрифтом)
К числу их прежде всего относится группа благородных газов: Не, Ne, Аr, Кr, Хе и Rn. Атомы их, как известно, обладают устойчивой двух-и восьмиэлектронной наружной оболочкой, чем и обусловлена их химическая инертность, т. е. неспособность вступать в какие-либо соединения с кислородом, водородом и другими элементами.
Особое положение в таблице занимает также группа благородных металлов (Ru, Rh, Pd, Ag, Os, Ir, Pt и Au), располагающихся в больших периодах менделеевской таблицы - пятом и шестом. Характерно, что в этих периодах атомные радиусы элементов в вертикальных группах почти тождественны (явление так называемого лантанидного сжатия атомных объемов). Это обстоятельство играет очень важную роль в химизме этих элементов в природных условиях, особенно в образовании изоморфных смесей для благородных металлов. Действительно, триада Ru, Rh, Pd гораздо теснее связана с триадой Os, Ir, Pt, нежели с триадой Fe, Со, Ni. Металлы платиновой группы, образуя твердые растворы, в месторождениях распространены всегда совместно. Элементы триады Fe, Со, Ni в составе этих минералов занимают обычно подчиненное положение. Еще резче проявлен изоморфизм для Au и Ag, тогда как Сu в виде твердого раствора в них встречается очень редко.
Из остальных встречающихся в самородном состоянии металлов, расположенных в субпериодах правой части таблицы, чаще других распространены так называемые полуметаллы: As, Sb и Bi. Несмотря на общность некоторых химических свойств этих элементов, они в природе наблюдаются в разных условиях. Лишь иногда мышьяк и сурьмяа дают интерметаллическое соединение AsSb.
Из неметаллических элементов водород в свободном состоянии с примесью других газов довольно часто устанавливается в некоторых горных породах и месторождениях полезных ископаемых. Азот и кислород, как известно, в значительных количествах входят в состав атмосферы. Для углерода характерно нахождение его в двух различных по кристаллическому строению модификациях. Самородная сера в главной своей массе возникает путем частичного окисления H2S, реже при восстановлении SO2, а также некоторых сернокислых и органических соединений, богатых серой.
Общее число минеральных видов и разновидностей, относящихся к данному разделу, по химическому составу достигает 80, т. е. оно значительно больше, чем число элементов, в них входящих. Некоторые элементы, как известно, устанавливаются в двух или более полиморфных модификациях (алмаз, графит, α-сера, β-сера и др.). Ряд элементов, кроме того, что встречается в чистом виде, образует твердые растворы друг с другом, например: электрум (Au,Ag), палладистая платина (Pt,Pd).
Распространены также интерметаллические соединения, обладающие стехиометрическими формулами и характеризующиеся своими особенностями кристаллической структуры (например, альгодонит - Cu3As, стибиопалладинит - Pd3Sb, дискразит - Ag3Sb и др.). Кроме определенных соединений, встречаются и соединения переменного состава, например: (Pt, Fe), (Pt, Сu) и др. Количество искусственно получаемых интерметаллических соединений достигает огромной цифры.
Кристаллические структуры и физические свойства минералов. Самородные элементы, встречающиеся в твердом состоянии, обладают различными кристаллическими структурами. По типу сил связей между атомами преобладающее значение имеют атомные структуры плотнейшей упаковки с металлической связью, иногда с признаками связей, переходных к гетерополярной и вандерваальсовской. Этими особенностями обусловлен ряд важных общих свойств самородных металлов.
Из всех природных веществ самородные металлы обладают наилучшей электропроводностью и теплопроводностью. Все они в полированном виде обладают сильным металлическим блеском, т. е. высокой отражательной способностью. Показатели преломления, от которых зависит блеск, являются наивысшими. Лишь для золота, серебра и меди они меньше 1,0, но это также обусловливает высокую отражательную способность (см. рис. 20). Точно так же и показатели поглощения света исключительно высоки.
Цвет преобладающего большинства самородных металлов серебряно- или оловянно-белый. Бросающимся в глаза исключением являются цвета золота и меди. Эти элементы могут обнаруживать более высокие валентности, чем следует по их положению в таблице элементов (CuCl2, АuСl3).
Допускают, что избирательное отражение света связано с особенностями строения атомных ядер этих элементов.
Из всех известных минералов самородные металлы обладают наибольшими удельными весами (особенно минералы элементов платиновой группы). Металлы, структура которых характеризуется координационным числом 12 и отсутствием направленных сил связей, обладают высокой ковкостью, отсутствием ясно выраженной спайности в изломе и обычно невысокой твердостью В отношении твердости исключение составляют лишь иридий и минералы, содержащие этот элемент в значительных количествах.
Благородные металлы, характеризующиеся лантанидным сжатием атомных объемов, более устойчивы в химическом отношении. Вследствие этого золото и минералы платиновой группы широко распространены в россыпях речных долин.
Физические свойства группы полуметаллов (мышьяка, сурьмы и висмута), характеризующихся как бы частично искаженными кубическими решетками, несколько отличаются от свойств типичных металлов. Меньшие отклонения в строении кристаллической решетки наблюдаются у висмута, который обладает наибольшим в данной группе блеском, наименьшей хрупкостью, наименьшей твердостью и др. Общими для всех трех металлов являются морфологические особенности кристаллов и направления спайности, что строго согласуется с особенностями их кристаллического строения.
Металлоиды по кристаллическим структурам и связанным с ними свойствам совершенно не похожи на типичные металлы. На характеристике их подробно остановимся при описании минералов.
|
ПОИСК:
|
© IZNEDR.RU, 2008-2020
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'
При использовании материалов сайта активная ссылка обязательна:
http://iznedr.ru/ 'Из недр Земли'